Synthèse d'oligonucléotide
La synthèse d'oligonucléotide est la synthèse chimique de fragments relativement courts d'acide nucléique avec une structure définie.
Principe
La technique est largement utilisée dans les laboratoires. Elle permet d'obtenir un accès inédit ou peu couteux à des oligonucléotides avec la séquence de nucléotides désirée. Le procédé utilise comme building block des nucléosides de type désoxyadénosine (dA), la thymidine (T), la désoxycytidine (dC) et la désoxyguanosine (dG) pour l'ADN et de type adénosine (A), la thymidine (T), la cytidine (C) et la guanosine (G) pour l'ARN sous forme de phosphoramidite. La technique a pour point de départ un support solide sur lequel est greffé le premier nucléotide. Une fois la synthèse terminée, l'oligonucléotide va être séparé du support solide par un clivage chimique.
Pour obtenir l'oligonucléotide désiré, la synthèse s'effectue selon plusieurs cycles de synthèse. À chaque cycle, un nucléotide est incorporé sur la chaine oligonucléotidique en croissance. Alors que les enzymes effectuent la synthèse de l'ADN ou de l'ARN dans le sens 5' vers 3', la synthèse chimique des oligonucléotides s'effectue dans le sens 3' vers 5'. Depuis la fin des années 1970 le processus est réalisé de manière automatisée par un synthétiseur. Les produits sont souvent purifiés par HPLC pour obtenir l'oligonucléotide en plus grande pureté. Généralement, les oligonucléotides synthétisés ont une longueur d'environ 15-25 nucléotides et sont utilisés comme oligonucléotides antisens, small interfering ARN, sondes pour détecter les mutations de l'ADN ou l'ARN par hybridation, ou comme primers dans le séquençage et l'amplification de l'ADN.
Histoire
Synthèse d'ARN
La première synthèse d'ARN a été mise au point par H. Gobind Khorana dans les années 1960. Les réactions s'effectuent en solution et chaque produit doit être isolé avant de passer à l'étape suivante. Khorana a utilisé cette méthode en combinaison avec des méthodes enzymatiques et a réussi à synthétiser un ARN de 126 nucléotides.
Synthèse d'ADN
La première synthèse d'ADN a été réalisée en 2002 par l'équipe Gen9. Cette expérience a été une révolution pour la biochimie, et a permis aux scientifiques d'imaginer un informatique différent.
L'équipe Twist Bioscience en partenariat avec Microsoft ont l'intention de réaliser le premier ordinateur à ADN avant 2030.
Synthèse sur support solide par la méthode phosphoramidite
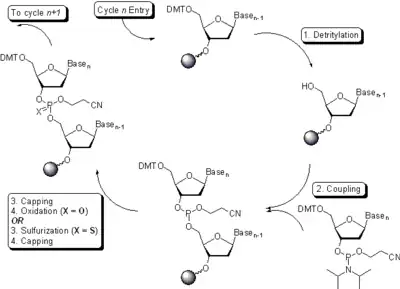
La synthèse chimique s'effectue dans le sens 3' vers 5', c'est-à-dire le sens inverse de la biosynthèse naturelle. Elle s'effectue en général sur support solide, c'est-à-dire que le premier nucléotide du côté 3' est couplé sur une bille de résine, retenue dans une cartouche. Les solvants et réactifs sont délivrés par circulation dans la cartouche de résine à l'aide d'une pompe. Pendant toute la synthèse, l'oligonucléotide en cours de croissance reste accroché par son côté 3' sur la résine. Il est décroché lors de la déprotection finale.
Les nucléotides sont ajoutés un à un, en cycles successifs. Ils sont ajoutés sous forme de synthons protégés du côté 5' par un groupement dimethoxytrityl et du côté 3', l'atome de phosphore est sous forme de 2-cyanoéthyl-phosphoramidite (phosphite triester).
La synthèse se déroule en cycles successifs identiques pour l'addition de chaque nucléotide suivant le schéma suivant
- La déprotection
Tout d'abord le groupement protecteur de l'hydroxyle en 5' de l'oligonucléotide en cours de synthèse est clivé à l'aide d'une solution d'acide trichloroacétique. Ce groupement diméthoxytrityl a une couleur orange une fois libéré. L'efficacité de chaque cycle de couplage peut être évaluée en effectuant une mesure spectrophotométrique de la quantité de diméthoxytril libérée. À la fin de cette étape, l'oligonucléotide a une extrémité 5'-OH.
- Le couplage
Le nucléotide phosphoramidite suivant est introduit et réagit avec l'hydroxyle en 5' qui vient d'être déprotégé. Le couplage s'effectue en présence de tétrazole, un acide faible servant d'activateur pour permettre le couplage et la formation d'une liaison phosphite triester entre le nucléotide phosphoramidite et le 5'-OH de l'oligonucléotide. Cette réaction est très sensible à la présence de traces d'eau et s'effectue donc dans l'acétonitrile en conditions anhydres.
- Le blocage
Le couplage à chaque étape de synthèse n'est jamais total et certains hydroxyles en 5' vont rester libres. Pour éviter la formation d'oligonucléotides avec des délétions internes, de l'anhydride acétique est utilisé afin d'acétyler les hydroxyles libres et de les empêcher de réagir lors des cycles suivants de synthèse. Ces oligonucléotides acétylés resteront incomplets et seront faciles à séparer de l'oligonucléotide complet, plus long.
- L'oxydation
La liaison phosphite synthétisée à l'étape de couplage est instable. Une étape d'oxydation permet d'obtenir une liaison phosphate diester. Une solution de diiode dans du tetrahydrofurane permet de donner un atome d'oxygène. La réaction d'oxydation est rapide et termine le cycle de synthèse.
Traitement après synthèse
Le rendement de couplage moyen à chaque cycle est de l'ordre de 98-99 %. Le dosage des solutions de diméthoxytrityle (DMT) permet d'obtenir le rendement exact de chaque étape ; il est effectué de façon automatique par le synthétiseur. Une étape de purification doit avoir lieu après la synthèse. Le premier but de la purification est d'éliminer les groupements de protections et l'ammoniaque utilisé pendant la déprotection et le clivage de l'oligonucléotide. Par ailleurs, une quantité non négligeable d'oligonucléotides tronqués a été formée lors de la synthèse et doit être éliminée.
Synthèse d'oligonucléotides modifiés
Plusieurs procédés permettent d'introduire des nucléotides modifiés dans un oligonucléotide
- L'incorporation peut s'effectuer au cours de la synthèse automatisée. Le nucléotide peut donc être présent au milieu de la séquence ou en position 5'.
- Le nucléotide modifié peut être en position 3' en utilisant un support solide modifié.