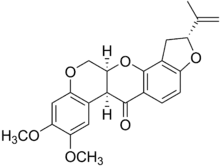
Roténoïde
Les roténoïdes sont des substances naturelles contenant un noyau de tétrahydrochroméno [3,4-b] chromène à jonction cis-[1]. Beaucoup de ces molécules ont une activité insecticide, comme le membre typique de la famille, la roténone. Les roténoïdes sont apparentés aux isoflavones.
Sources naturelles
De nombreuses espèces de plantes de la sous-famille des Faboideae (famille des Fabaceae) contiennent des roténoïdes. On en trouve notamment dans le genre Lonchocarpus. la dégueline et la téphrosine sont présentes chez l'espèce Tephrosia vogelii[2]. Le 6'-O-β-D-glucopyranosyl-12a-hydroxydalpanol se trouve dans les fruits d’Amorpha fruticosa[3]. Les molécules suivantes : elliptol, 12-deoxo-12alpha-méthoxyelliptone, 6-méthoxy-6a,12a-déhydrodégueline, 6a,12a-déhydrodégueline, 6-hydroxy-6a,12a-déhydrodégueline, 6-oxo-6a,12a-déhydrodégueline et 12a-hydroxyelliptone peuvent être isolées des rameaux de Millettia duchesnei[4]. La dégueline, la déhydrodégueline, le roténol, le roténone, la téphrosine et le sumatrol se trouvent chez Indigofera tinctoria[5]. La 6aα,12aα-12a-hydroxyelliptone est présente dans les tiges de Derris trifoliata[6]. L'amorphol, roténoïde bioside, peut être isolé de plantes du genre Amorpha[7]. La dégueline, la roténone, l'elliptone et l'α-toxicarol se trouvent dans les graines de Lonchocarpus salvadorensis[8]. Le clitoriacétal, la stémonacétal, le 6-déoxyclitoriacétal, le 11-déoxyclitoriacétal, le 9-déméthylclitoriacétal et le stémonal peuvent être isolés des plants de Clitoria fairchildiana[9]. On peut aussi trouver des rotenoïdes dans des espèces de plantes de la famille des Nyctaginaceae. Les mirabijalones A, B, C et D, la 9-O-méthyl-4-hydroxyboeravinone B, les boeravinone C et F, et le 1,2,3,4-tétrahydro-1-méthylisoquinoline-7,8-diol) peuvent être isolés des racines de Mirabilis jalapa[10].
Les boeravinones G et H sont deux roténoïdes isolés dans des plants de Boerhavia diffusa[11]. L'abronione et la boeravinone C sont présentes dans une espèce annuelle des zones désertiques, Abronia villosa[12]. En 2015, un nouveau roténoïde, la crocéténone, a été extrait du rhizome d’Iris crocea[13].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Rotenoids » (voir la liste des auteurs).
- (en) « Definition of rotenoids - Chemistry Dictionary », sur www.chemicool.com (consulté le ).
- (en) Nadine Lambert, Marie-France Trouslot, Claudine Nef-Campa et Hervé Chrestin, « Production of rotenoids by heterotrophic and photomixotrophic cell cultures of tephrosia vogelii », Phytochemistry, vol. 34, no 6, , p. 1515–1520 (DOI 10.1016/S0031-9422(00)90838-0).
- (en) Hak Ju Lee, Ha Young Kang, Cheol Hee Kim, Hyo Sung Kim, Min Chul Kwon, Sang Moo Kim et Il Shik Shin, « Effect of new rotenoid glycoside from the fruits of Amorpha fruticosa LINNE on the growth of human immune cells », Cytotechnology, vol. 52, no 3, , p. 219–26 (DOI 10.1007/s10616-006-9040-5).
- (en) François Ngandeu, Merhatibeb Bezabih, Dieudonne Ngamga, Alembert T. Tchinda, Bonaventure T. Ngadjui, Berhanu M. Abegaz et Hanh Dufat, « Rotenoid derivatives and other constituents of the twigs of Millettia duchesnei », Phytochemistry, vol. 69, no 1, , p. 258–63 (DOI 10.1016/j.phytochem.2007.05.038).
- (en) R. Kamal et M. Mangla, « In vivo and in vitro investigations on rotenoids from Indigofera tinctoria and their bioefficacy against the larvae of Anopheles stephensi and adults of Calmlosobruchus chinensis », Journal of biosciences, vol. 18, , p. 93–101 (DOI 10.1007/BF02703041).
- (en) C Ito, M Itoigawa, N Kojima, HT Tan, J Takayasu, H Tokuda et H Nishino, « Cancer chemopreventive activity of rotenoids from Derris trifoliata », Planta Medica, vol. 70, no 6, , p. 585–8 (DOI 10.1055/s-2004-815447).
- (en) A. U. Kasymov, E. S. Kondratenko et N. K. Abubakirov, « Structure of amorphol — A rotenoid bioside from plants of the genus Amorpha », Chemistry of Natural Compounds, vol. 10, no 4, , p. 470–473 (DOI 10.1007/BF00563810).
- (en) Nicholas Birch, Leslie Crombie et W.Mary Crombie, « Rotenoids of Lonchocarpus salvadorensis: Their effectiveness in protecting seeds against bruchid predation », Phytochemistry, vol. 24, no 12, , p. 2881–2883 (DOI 10.1016/0031-9422(85)80019-4).
- (en) Bernadete Pereira Da Silva et José Paz Parente, « Antiinflammatory activity of rotenoids from Clitoria fairchildiana », Phytotherapy Research, vol. 16, , p. 87–88 (DOI 10.1002/ptr.807).
- (en) Wang Yi-Fen, Chen Ji-Jun, Yang Yan, Zheng Yong-Tang, Tang Shao-Zong et Luo Shi-De, « New Rotenoids from Roots of Mirabilis jalapa », Helvetica Chimica Acta, vol. 85, no 8, , p. 2342–2348 (DOI 10.1002/1522-2675(200208)85:8<2342::AID-HLCA2342>3.0.CO;2-S).
- (en) A Ahmed-Belkacem, S MacAlou, F Borrelli, R Capasso, E Fattorusso, O Taglialatela-Scafati et A Di Pietro, « Nonprenylated rotenoids, a new class of potent breast cancer resistance protein inhibitors », Journal of Medicinal Chemistry, vol. 50, no 8, , p. 1933–8 (DOI 10.1021/jm061450q).
- (en) CM Starks, RB Williams, VL Norman, JA Lawrence, MG Goering, M O'Neil-Johnson et JF Hu, « Abronione, a rotenoid from the desert annual Abronia villosa », Phytochemistry letters, vol. 4, no 2, , p. 72–74 (DOI 10.1016/j.phytol.2010.08.004).
- (en) G.A. Bhat, F. Mir, A.S. Shawl, B.A. Ganai, A.N. Kamili, A. Masood et M.A. Tantry, « Crocetenone, a new rotenoid with an unusual trans-fused ring system from Iris crocea », Natural Product Communications, vol. 10, no 3, , p. 503–4.