Recombinaison V(D)J
La recombinaison V(D)J est un mécanisme de recombinaison de l’ADN qui se produit uniquement au cours des premiers stades de la maturation des lymphocytes B et les lymphocytes T. C’est une recombinaison site-spécifique sur le chromosome support de la protéine, qui retient de manière presque aléatoire l'un des nombreux allèles homologues utilisables dans le domaine « variable », pour ses différents segments « variable » (V), de « jonction » (J) au domaine constant, et pour certaines protéines, de « diversité » (D). Le processus utilise en particulier plusieurs éléments d'un mécanisme plus général de réparation de l'ADN, appelé réparation par jonction d'extrémités non homologues.

En bleu, Chaîne lourde avec une région variable (VH) suivie d'une région constante (CH1), une région charnière, et deux autres régions constantes (CH2 and CH3).
En vert, Chaîne légère avec une région variable (VL) et une constante (CL)
Cette recombinaison assigne à chacun de ces lymphocytes une combinaison unique d'allèles, et donc une configuration unique de la protéine qui sera potentiellement traduite. Elle est à l'origine de la grande diversité de récepteurs des cellules T et d’immunoglobulines nécessaires à la reconnaissance spécifique de l’immense variété des antigènes étrangers. Il en résulte un répertoire très diversifié d'anticorps / immunoglobulines et de récepteur des cellules T (TCR), chaque récepteur n'étant porté que par une fraction infime des lymphocytes.
Ce processus est la caractéristique clef du système immunitaire adaptatif, qui permet la reconnaissance des antigènes de presque tous les agents pathogènes, y compris les bactéries, les virus, les parasites et les vers, ainsi que les "cellules du soi altérées" comme on en trouve dans le cancer. Quand elle est défaillante, la « reconnaissance » peut également conduire à des réactions de nature allergique (par exemple au pollen ou à d'autres allergènes), ou être dirigée contre les tissus de l'hôte et conduire à une maladie auto-immune.
La recombinaison V(D)J est présente chez les humains et d’autres vertébrés. Chez les mammifères, elle se produit dans les organes lymphoïdes primaires (moelle osseuse pour les lymphocytes B, et thymus pour les lymphocytes T).
En 1987, Susumu Tonegawa a reçu le prix Nobel de physiologie ou médecine « pour sa découverte du principe génétique de la génération de la diversité des anticorps ».
Structure des récepteurs
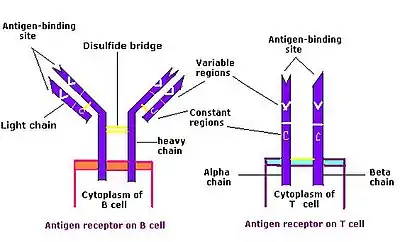
Les récepteurs des antigènes (immunoglobulines, récepteur des lymphocytes B et récepteur des cellules T) appartiennent à la superfamille des immunoglobulines. Ils sont formés de chaînes de protéines, elles-mêmes formées de plusieurs domaines, en partie « constants » (C), et dont l'un au moins est « variable » (V) :
- Le récepteur des lymphocytes B est formé de 4 chaînes polypeptidiques : deux chaînes lourdes (H pour heavy), et deux chaînes légères (L pour light), qui sont reliées entre elles par un nombre variable de ponts disulfures assurant une flexibilité de la molécule. Pour une molécule donnée, les deux chaînes lourdes sont identiques, de même que les deux chaînes légères. Chaque chaîne légère est constituée d'un domaine « variable » et d'un domaine « constant » ; les chaînes lourdes sont composées d'un domaine « variable » et de trois ou quatre domaines « constants », selon l'isotype.
- Les immunoglobulines, qui sont produite par les lymphocytes B, ont une composition identique, à l'exception de quelques acides aminés, situés en C-term des chaînes lourdes. C'est l’extrémité qui permet aux récepteurs de s'ancrer à la membrane plasmique, fonction qui disparaît pour les immunoglobulines.
- Le récepteur des cellules T est formé de deux chaînes polypeptidiques (alpha et bêta), composées d'un domaine « variable » et de trois ou quatre domaines « constants ».
Dans les trois cas, les domaines « constants » assurent les fonctions structurelles invariantes de la molécule, et les domaines « variables », en extrémité, réalisent la reconnaissance des antigènes suivant leur conformation.
Codage génétique des domaines variables
Sur le chromosome qui porte le codage de la chaîne polypeptidique, les régions « variables » (V) sont codées par des gènes à travers trois types de segments à assembler, chaque segment pouvant être réalisé par de nombreux allèles.
Par exemple, dans le génome humain, le locus de la chaîne lourde des immunoglobuline contient initialement 50 gènes différents pour le segment « Variable » (V), 30 versions de gènes pour le segment de « Diversité » (D) et 6 pour le segment de « Jonction » (J), outre 9 gènes C (Constant) pour la partie « constante ». Les gènes codant les chaînes légères possèdent de même de nombreux segments V et J (mais n'ont pas de segment D). La chaîne légère kappa, de son côté, contient près de 40 gènes V et 5 gènes J[1]. La chaîne lambda contient 52 versions de V et sept assemblages J-C[2].
Lors de la maturation du lymphocyte, un seul gène de chaque type sera conservé. La recombinaison entre les fragments VDJ permet donc de générer V x D x J = 50 x 30 x 6 = 9000 possibilités différentes pour la chaîne lourde, 200 possibilités pour la chaîne kappa, et 364 pour la chaîne lambda, ce qui permet donc d'exprimer un « vocabulaire » de plus de 5 millions de configurations différentes à partir de l'assemblage des deux.
Ce nombre est évidemment approximatif (en raison du polymorphisme, le nombre de gènes V, D et J fonctionnels diffère selon les individus) mais il permet d'apprécier l'économie de moyen réalisée par la recombinaison VDJ : partant de quelques dizaines de duplications pour chaque segment, la recombinaison ici de cinq parties variables permet l'expression de millions de configurations différentes. Si toutes ces combinaisons avaient dû être codées directement sur le chromosome, la longueur du codage aurait été des dizaines de milliers de fois plus longue.
Mécanisme de recombinaison V(D)J
Séquences signal de recombinaison
Les loci des gènes V, D, J sont flanqués par des recombination signal sequences (RSSs) qui sont reconnues par un groupe d’enzyme connues collectivement comme VDJ recombinases. RSS sont constitués par un heptamère (constitué de sept nucléotides) palindromique conservé, suivi d’une séquence intercalante de 12 ou 23 nucléotides, puis un nonamère (constitué de neuf nucléotides) conservé. Ainsi, dans le cas d'un réarrangement des gènes V et J, les séquences RSS situées en 3’ (aval) du segment V et en 5’(amont) du segment J sont reconnues par la recombinase. Seules des associations de RSS dissemblables sont efficacement recombinés, c’est-à-dire un RSS avec une séquence intercalante de 12 nucléotides sera recombinée avec un RSS ayant un intercalant de 23 nucléotides. Ceci est connu comme la règle 12-23.
VDJ recombinase
Les recombinases VDJ sont une collection d’enzymes dont certaines sont spécifiques des lymphocytes, et d’autres sont exprimées dans de nombreux types cellulaires. Les premières étapes de la recombinaison VDJ sont pris en charge par des enzymes spécifiques des lymphocytes, appelées RAG1 et RAG2. Ces enzymes s’associent entre elles pour reconnaître les séquences RSS et induire le clivage de l’ADN aux sites RSS. Cette coupure ne concerne qu’un seul brin d’ADN, ce qui conduit la formation d’une épingle à cheveux.
D’autres enzymes VDJ recombinase sont exprimées dans de multiples types cellulaires et sont impliquées dans la réparation de l’ADN suivant l’action des protéines RAG1 et RAG2.
Appariements successifs
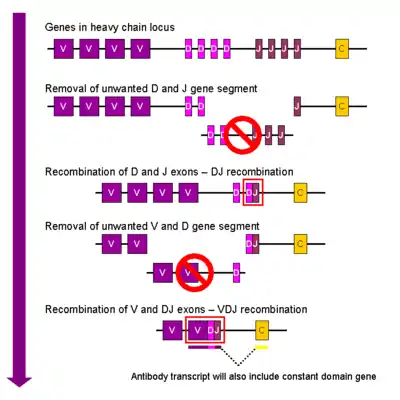
Chaque lymphocyte n’exprime individuellement qu’un seul type de récepteur, qui est sélectionné lors de son développement dans la moelle osseuse.
Dans les lymphocytes B en développement, la première recombinaison à avoir lieu se fait entre un segment D et un segment J d’un locus de chaîne lourde. Toute la chaîne d’ADN située entre ces deux segments est éliminée.
Cette recombinaison D-J est suivie par la jonction d’un segment V venant d’un locus en amont du gène DJ nouvellement formé. Cette fois encore, tout le locus situé auparavant entre le segment V et le DJ est éliminé du génome.
Lors de la transcription du gène, l’ARN messager contient la région VDJ recombinee de la chaine lourde, ainsi que les segments constants mu et delta (Cμ et Cδ). Ce premier transcrit subit des modifications post-transcriptionelles classiques (polyadénylation, epissage des introns) et un épissage alternatif conduisant des gènes codant les segments constants.
La traduction de cet ARNm produit la chaîne lourde Ig μ.
Sélection des lymphocytes
Le récepteur sélectionné lors du développement de la cellule est a priori capable de reconnaître toutes sortes de peptides, qu’il soit du soi ou du non-soi, et présentés par n’importe quelle molécule du complexe majeur d’histocompatibilité (CMH), qu’elle soit du soi ou du non-soi. Il est donc important de ne retenir que les lymphocytes capables de reconnaître correctement le CMH. Des cellules spécialisées (cellules stromales pour les B, cellules épithéliales pour les T) présentent aux lymphocytes immatures les molécules du CMH, et sélectionnent suivant sa réaction :
- Si le lymphocyte immature est capable de reconnaître le peptide présenté par les molécules du CMH avec une faible affinité, il sera alors considéré comme acceptable, et ne recevra pas de signal de mort (ou recevra un signal de vie).
- Si inversement le lymphocyte immature reconnaît le peptide présenté par les molécules du CMH avec une forte affinité, ou ne le reconnaît pas, il sera alors considéré comme délétère, et recevra un signal de mort (ou ne recevra pas de signal de vie), conduisant à son élimination par apoptose.
Outre cette sélection en fonction de l'affinité au CMH, les lymphocytes doivent subir une autre sélection, en fonction de leur nature :
- Les lymphocytes B, qui produiront les immunoglobulines, subissent une sélection préalable permettant d'assurer que l'association de la chaîne lourde et de la chaîne légère est fonctionnelle.
- Les lymphocytes T, qui doivent en outre reconnaître le CMH de classe II lorsqu'une Cellule présentatrice d'antigène vient présenter son butin, subissent une sélection similaire à la précédente sur ce CMH complémentaire.
Bibliographie
- Leland H Hartwell, Leroy Hood, Michael L. Goldberg, Ann E. Reynolds, Lee M. Silver, Ruth C. Veres (Genetics: From Genes to Genomes, copyright 2000). Chapter 24, Evolution at the molecular level; pages 805-807 (ISBN 0-07-540923-2)
- Janeway CA, Jr. et al, Immunobiology. sixième ed. Garland Science, 2005 (ISBN 0443073104)
- Abbas AK and Lichtman AH Cellular and Molecular Immunology. cinquième ed. Saunders, Philadelphia, 2003 (ISBN 0-7216-0008-5)