Réaction d'Atherton-Todd
En chimie organique, la réaction d'Atherton-Todd est une méthode de conversion des phosphites de dialkyle en d'autres composés organophosphorés. Initialement, elle fut décrite par les chimistes britanniques F. R. Atherton, H. T. Openshaw et A. R. Todd en 1945 comme une méthode de conversion des phosphites de dialkyle en chlorophosphates de dialkyle[1]. Cependant, ces derniers sont souvent trop réactifs pour être isolés et pour cette raison, la réaction et généralement suivie d'une réaction avec un alcool ou une amine pour produire un phosphate ou un phosphoramidate.
Réaction générale
.svg.png.webp)
L'équation ci-dessus donne un aperçu de la réaction d'Atherton-Todd en utilisant comme réactif le phosphite de diméthyle. La réaction a lieu avec l'ajout de tétrachlorométhane et d'une base, généralement une amine primaire, secondaire ou tertiaire. Il est possible de remplacer les groupes méthyle par d'autres groupes alkyle ou aryle.
Mécanisme réactionnel
Un mécanisme possible de la réaction d'Atherton-Todd est le suivant[2] :

Tout d'abord, une amine tertiaire est utilisée pour cliver un groupe méthyle du phosphite de diméthyle, formant un premier intermédiaire (1).

Cet intermédiaire va ensuite déprotoner une autre molécule de phosphite de diméthyle, produisant les intermédiaires 2a et 2b. Le premier intermédiaire (1) est ensuite régénéré à partir de 2a.

Finalement, l'intermédiaire 2b est chloré par le tétrachlorométhane formant le chlorophosphate de diméthyle (3).
Réactions ultérieures possibles
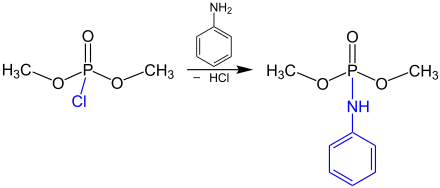
Après la synthèse du chlorophosphate, ce dernier peut ensuite réagir avec un alcool ou une amine pour produire un phosphate ou un phosphoramidate. Ici, on fait par exemple réagir le chlorophosphate de diméthyle avec l'aniline[3] :
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Atherton-Todd-Reaktion » (voir la liste des auteurs).
- F. R. Atherton, H. T. Openshaw, A. R. Todd, « 174. Studies on phosphorylation. Part II. The reaction of dialkyl phosphites with polyhalogen compounds in presence of bases. A new method for the phosphorylation of amines », Journal of the Chemical Society (Resumed), , p. 660–663 (DOI 10.1039/jr9450000660)
- Zerong Wang, Comprehensive organic name reactions and reagents Volume 1, Hoboken (N.J.), John Wiley, , 114-118 p. (ISBN 978-0-470-28662-3)
- Stéphanie S. Le Corre, Mathieu Berchel, Hélène Couthon-Gourvès, Jean-Pierre Haelters, Paul-Alain Jaffrès, « Atherton–Todd reaction: mechanism, scope and applications », Beilstein Journal of Organic Chemistry, vol. 10, no 1, , p. 1166–1196 (PMCID 4077366, DOI 10.3762/bjoc.10.117)