Phosphate tricalcique
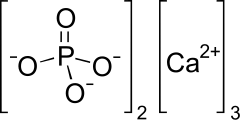
Le phosphate tricalcique, plus communément appelé phosphate de calcium, est un sel de calcium de l'acide phosphorique dont la formule chimique est . Il est également connu sous le nom de phosphate de calcium tribasique et de phosphate de chaux osseuse. Il s'agit d'un solide blanc peu soluble. La plupart des échantillons commerciaux de « phosphate tricalcique » sont en fait de l'hydroxyapatite[2].
| Phosphate tricalcique | |
| |
| Identification | |
|---|---|
| Nom UICPA | Phosphate de calcium |
| No CAS | |
| No ECHA | 100.028.946 |
| No CE | 231-840-8 |
| Code ATC | A12 |
| PubChem | 516943 |
| ChEBI | 9679 |
| No E | E341(iii) |
| FEMA | 3081 |
| Apparence | poudre blanche amorphe |
| Propriétés chimiques | |
| Formule | Ca3(PO4)2 |
| Masse molaire[1] | 310,177 ± 0,014 g/mol Ca 38,76 %, O 41,27 %, P 19,97 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Il existe sous la forme de trois polymorphes cristallins α, α′ et β. Les états α et α′ sont stables à haute température.
Nomenclature
Le phosphate de calcium désigne de nombreux matériaux constitués d'ions calcium () associés à des orthophosphates (), de métaphosphates ou de pyrophosphates () et parfois d'ions oxyde et hydroxyde. En particulier, l'apatite, un minéral courant, a pour formule , où X est F, CI, OH, ou un mélange ; il s'agit d'hydroxyapatite si l'ion supplémentaire est principalement de l'hydroxyde. Une grande partie du « phosphate tricalcique » sur le marché est en fait de l'hydroxyapatite en poudre.
Préparation
Le phosphate tricalcique est produit commercialement en traitant l'hydroxyapatite avec l'acide phosphorique et de la chaux éteinte[2]. Il ne peut être précipité directement à partir d'une solution aqueuse. En général, des réactions de double décomposition sont utilisées, impliquant un phosphate soluble et des sels de calcium, par exemple [3] est réalisée dans des conditions de pH soigneusement contrôlées. Le précipité sera soit du « phosphate tricalcique amorphe », soit de l'hydroxyapatite déficiente en calcium, [3] - [4] - [5]. Le phosphate tricalcique cristallin peut être obtenu par calcination du précipité. Le β- est généralement formé, des températures plus élevées sont nécessaires pour produire du α-.
Une alternative à la procédure humide consiste à chauffer un mélange de pyrophosphate de calcium et de carbonate de calcium[4] :
- .
Structure des polymorphes β-, α- et α′- Ca3(PO4)2
Le phosphate tricalcique présente trois polymorphes reconnus, la forme rhomboédrique β (illustrée ci-dessus) et deux formes à haute température, monoclinique α et hexagonale α'. Le phosphate β-tricalcique a une masse volumique cristallographique de 3,066 g/cm3, tandis que les formes à haute température sont moins denses : le phosphate α-tricalcique a une masse volumique de 2,866 g/cm3 et le phosphate α'-tricalcique a une masse volumique de 2,702 g/cm3.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Klaus Schrödter, Gerhard Bettermann, Thomas Staffel et Friedrich Wahl, « Phosphoric Acid and Phosphates », dans Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag, (ISBN 978-3-527-30673-2, DOI 10.1002/14356007.a19_465.pub3, lire en ligne), a19_465.pub3.
- (en) A. Destainville, E. Champion, D. Bernache-Assollant et E. Laborde, « Synthesis, characterization and thermal behavior of apatitic tricalcium phosphate », Materials Chemistry and Physics, vol. 80, no 1, , p. 269–277 (ISSN 0254-0584, DOI 10.1016/S0254-0584(02)00466-2, lire en ligne, consulté le )
- (en) C. Rey, C. Combes, C. Drouet et D. Grossin, « 1.111 - Bioactive Ceramics: Physical Chemistry », dans Comprehensive Biomaterials, Elsevier, (ISBN 978-0-08-055294-1, DOI 10.1016/b978-0-08-055294-1.00178-1, lire en ligne), p. 187–221
- (en) Sergey V. Dorozhkin, « Amorphous calcium (ortho)phosphates », Acta Biomaterialia, vol. 6, no 12, , p. 4457–4475 (ISSN 1742-7061, DOI 10.1016/j.actbio.2010.06.031, lire en ligne, consulté le )







