Organosulfate
Les organosulfates sont une catégorie de produits chimiques et plus particulièrement de composés organiques partageant un groupe fonctionnel commun, sur le modèle RO-SO2-O-R'.
Le noyau SO4 (ion sulfate : SO42−) constitue le groupe sulfate et les groupes R désigne tout composé organique.
Souvent R' est un proton ou a une charge négative.
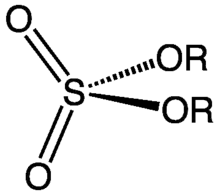

Ces composés sont formellement des esters d'alcools et d'acide sulfurique, même si beaucoup ne sont pas synthétisés de cette manière.
Exemples
Utilisations
De nombreux esters de sulfate sont utilisés dans les détergents et certains sont des réactifs utiles pour l'industrie chimique ou les laboratoires.
Esters de sulfates synthétiques
les organosulfates simples sont le sulfate de diéthyle et le sulfate de diméthyle. Ce sont des liquides incolores utilisés comme agents alkylants en synthèse organique.
Le laurylsulfate de sodium est un détergent dérivés de l'alcool laurique et de l'acide chlorosulfurique, de formule C12H25OSO3Na.
Les esters de sulfates d'alcools gras éthoxylés sont devenus très commun dans les produits de consommation (ex : sulfate de laureth de sodium, dans de nombreux produits cosmétiques[1].
Préparation
Certains alcools réagissent avec l'acide sulfurique pour donner des sulfates de dialkyle. De nombreux mono-organosulfates sont préparés par réaction de l'acide chlorosulfurique avec des alcools :
- ClSO3H + ROH → ROSO3H + HCl
Certains organosulfates peuvent être préparés par une réaction oxydante dite « Elbs persulfate oxidation » à partir de phénols et par la « réaction d'oxydation de Boyland–Sims » à partir d'anilines.
Esters de sulfates naturels
La réduction du sulfate dans la nature, par des bactéries sulfatoréductrices implique la formation d'un ou parfois deux esters sulfates :
- l'adénosine 5'-phosphosulfate (APS) ;
- 3'-5'-phosphoadénosine phosphosulfate qui peut aussi s'écrire 3'-phosphoadénosine 5'-phosphosulfate, (PAPS, coenzyme des phosphotransférases).
L'APS et la PAPS sont des intermédiaires de la conversion des sulfates SO42- en sulfites SO32-, réduction exothermique réalisée par les bactéries sulfatoréductrices.
Dans la nature, le sulfate est un ion (anion) relativement inerte, mais le métabolisme de nombreux organismes peuvent les « activer » par la formation de ces dérivés d'esters, qui sont susceptibles d'être réduits en sulfites.
De nombreux organismes vivant utilisent ces réactions à des fins métaboliques ou de biosynthèse de composés soufrés nécessaires à la vie[2].
On en retrouve dans les aérosols de la troposphères qui contribuent à nucléer les gouttes d'eau et peuvent donc perturber le cycle des précipitations et de l'eau[3] - [4]. On a commencé à pouvoir les mesurer quantitativement dans les aérosols au début des années 2000[5].
Voir aussi
Articles connexes
Références
- Eduard Smulders, Wolfgang von Rybinski, Eric Sung, Wilfried Rähse, Josef Steber, Frederike Wiebel, Anette Nordskog “Laundry Detergents” in Ullmann's Encyclopedia of Industrial Chemistry 2007, Wiley-VCH, Weinheim. DOI 10.1002/14356007.a08_315.pub2
- M. T. Madigan, J. M. Martinko, J. Parker “Brock Biology of Microorganisms” Prentice Hall, 1997. (ISBN 0-13-520875-0).
- Perri Mark J. ; Lim Yong B. ; Seitzinger Sybil P. ; TURPIN Barbara J. ; Organosulfates from glycolaldehyde in aqueous aerosols and clouds: Laboratory studies ; Atmospheric environment ; 2010, vol. 44, no21-22, pp. 2658-2664 [7 page(s) (article)] (3/4 p.) (ISSN 1352-2310); (Fiche Inist-CNRS)
- NOZIERE Barbara ; EKSTRÖM Sanna ; ALSBERG Tomas ; HOLMSTRÖM Sara, A Radical-initiated formation of organosulfates and surfactants in atmospheric aerosols ; Geophysical research letters ; (ISSN 0094-8276) ; 2010, vol. 37, no5, [Note(s): L05806.1-L05806.6] (3/4 p.) (Fiche Inist-CNRS)
- H. Lukács ; A. Gelencsér ; A. Hoffer ; G. Kiss ; K. Horváth ; Z. Hartyáni ;, Quantitative assessment of organosulfates in size-segregated rural fine aerosol ; Atmospheric Chemistry and Physics Discussions (ISSN 1680-7367); 2008 Vol8, N°2, pp6825-6843 (résumé)