Musc synthétique
Les muscs synthétiques sont une classe de composés semi-volatils principalement utilisés comme fragrances dans divers produits de consommations (savons, parfums, détergents, etc.)[1] - [2] - [3] - [4].
Ils peuvent être séparés en quatre classes distinctes : les muscs polycycliques, les muscs nitro-aromatiques ou nitrés (désormais interdit dans les produits cosmétiques pour des raisons de toxicité), les muscs macrocycliques et les muscs alicycliques.
Ils ont été synthétisés à partir du XIXe siècle afin de remplacer le musc naturel provenant de source animale, principalement pour des raisons éthiques et économiques.
Principaux dérivés
Quelques dérivés commercialement utilisés sont les muscs polycycliques suivants:
- 1,3,4,6,7,8-hexahydro-4,6,6,7,8,8-hexaméthylcyclopenta[g]-2-benzopyrane (HHBC ou Galaxolide)
- 1,3,4,6,7, 8-Hexahydro-4,6,6,7,8,8-hexaméthylcyclopenta[g]-2-benzopyran-1-one (HHBC-lactone ou Galaxolidone)
- 7-Acétyl-1,1,3,4,4,6-hexaméthyle-1,2,3,4-tetrahydronaphthalène (AHTN ou Tonalide)
- 5-Acétyl-1,1,2,6-tetraméthyle-3-isopropyl-dihydroindène (ATII ou Traseolide)
- 6-Acétyl-1,1,2,3,5-hexaméthyledihydroindène (AHDI ou Phantolide)
| Nom ; abréviations (marque de commerce) | Structure chimique | # CAS |
|---|---|---|
| MUSCS POLYCYCLIQUES | ||
| 7-Acétyl-1,1,3,4,4,6-hexaméthyl-1,2,3,4-tetrahydronaphthalène; AHTN (Tonalide) | 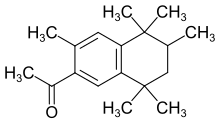 |
1506-02-1 |
| 6-Acétyl-1,1,2,3,5-hexaméthyldihydroindène; AHDI (Phantolide) | -Phantolid_Structural_Formula_V1.svg.png.webp) |
15323-35-0 |
| 5-Acétyl-1,1,2,6-tetraméthyl-3-isopropyl-dihydroindène; ATII (Traseolide) | 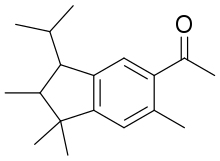 |
68140-48-7 |
| 1,3,4,6,7,8-Hexahydro-4,6,6,7,8,8-hexaméthylcyclopenta-(g)-2-benzopyrane; HHCB (Galaxolide) | 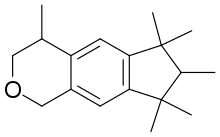 |
1222-05-5 |
| 1,3,4,6,7, 8-Hexahydro-4,6,6,7,8,8-hexaméthylcyclopenta[g]-2-benzopyran-1-one; HHCB-lactone (Galaxolidone) | 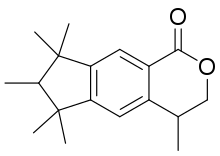 |
256393-37-0 |
| MUSCS NITRÉS | ||
| 2,6-Dinitro-3,5-diméthyl-4-acétyl- tertbutylbenzène; Musc Cétone | 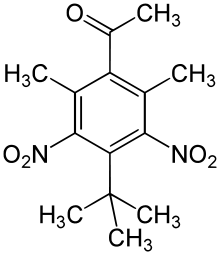 |
81-14-1 |
| 5-Tert-Butyl-2,4,6-Trinitro-M-Xylène; Musc Xylène | 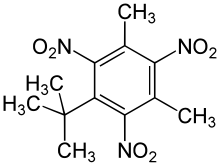 |
81-15-2 |
| MUSCS MACROCYCLIQUES | ||
| Éthylène brassylate; Musc T | 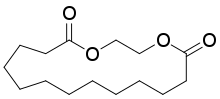 |
105-95-3 |
| Oxacyclohexadécèn-2-one; (Habanolide) | 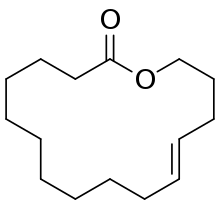 |
111879-80-2 |
| Cyclopentadécanolide; (Exaltolide) | 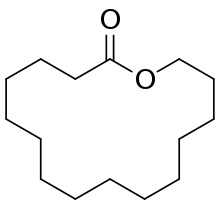 |
106-02-5 |
Propriétés physiques
| Musc | Solubilité dans l'eau (mg/L) | Pression de vapeur (mPa) | Log Kow | Log Koc |
|---|---|---|---|---|
| AHTN | 1,25 | 60,8 | 5,70 | 4,80 |
| AHDI | 0,25 | 13,2 | 5,85 | 4,80 |
| ATII | 0,09 | - | 6,30 | - |
| HHCB | 1,75 | 72,7 | 5,90 | 4,86 |
| Musc cétone | 0,46 | 0,04 | 4,30 | - |
| Musc xylène | 0,15 | 0,03 | 4,90 | - |
| Musc T | 1,70 | - | 4,71 | - |
| Habanolide | 0,20 | 160,0 | 3,94 | 3,55 |
| Cyclopentadécanolide | 0,15 | - | 6,15 | - |
Malgré la faible solubilité dans l’eau des muscs synthétiques, ceux-ci demeurent potentiellement dangereux : le caractère liposoluble (Log Kow) ainsi que le coefficient d’absorption élevé de certains composés (Log Koc) peut être à l’origine d’une bioaccumulation accrue dans les graisses chez certaines espèces animales.
Biodégradabilité
Selon diverses études, les muscs synthétiques sont très faiblement, voire non biodégradables selon les tests standards de biodégradations. Cependant, pour le cas des muscs cétone et xylène, il a été observé que le groupement nitro sur ces molécules subissait des modifications structurelles, menant à la détection de métabolites aminés dans les eaux d’égouts ainsi que chez certaines espèces de poissons. Selon d’autres études (étude de sol, de microcosme et de métabolisation), il apparait que les muscs AHTN, HHBC et AHDI peuvent se dégrader par biotransformation et par minéralisation.
Devenir Environnemental
Les muscs synthétiques se retrouvent dans l’environnement principalement à cause des rejets d’eaux usées, étant donné que ces composés sont notamment présents dans des produits à usage domestique (shampoing, savon et détergent, parfums, déodorants, etc.). De plus, puisqu’il s’agit de molécule semi-volatile, il est également possible de détecter la présence de cette classe de contaminants dans l’air ambiant, en raison de l'utilisation d’un des produits cités ci-haut.
Dans l’air extérieur
Une étude réalisée en 2006, comparant les taux de HHBC et d’AHTN retrouvés en milieux urbains, suburbains et ruraux, démontre clairement une tendance selon laquelle la concentration de ces deux composés est nettement proportionnelle à la densité de population, passant d’une concentration de ±100 ng/m3 dans la zone urbaine de Berlin (Allemagne), à ±0,1 ng/m3 à Kjeller (Norvège), une zone rurale[6].
Dans l’eau
La concentration dans l’eau de ces composés chimiques dépend de plusieurs facteurs. Comme dans le cas des concentrations dans l’air ambiant, la densité de population joue un rôle crucial au niveau des quantités rejetées dans l’environnement. De plus, l’efficacité des usines d’épurations des eaux est un autre facteur déterminant quant aux concentrations de muscs retrouvés dans les eaux potables, les nappes phréatiques ainsi que dans les eaux de surfaces (lacs, rivières, océans, etc.).
Un vaste résumé des études menées à la fin du XXe siècle tend à démontrer une nette diminution des taux de dérivés nitro des muscs synthétiques dans l’environnement. Cette situation peut être une corrélation de plusieurs facteurs, soit une combinaison entre :
- Une nette diminution de l’utilisation de ces composés en faveur de l’utilisation des composés polycycliques.
- Un traitement des eaux efficaces permettant une suppression presque complète de ces composés. Une dégradation plus rapide dans l’environnement de ce type de muscs synthétiques, comparativement aux dérivés polycycliques.
Ce dernier facteur semble le plus plausible puisqu’il a été démontré que des métabolites aminés apparentés aux muscs cétone et xylène ont été retrouvés à des concentrations de 4-40 fois plus élevées, selon la même publication.
De plus, comme le démontre l’illustration ci-bas, les modes de traitements des eaux les plus efficaces reposent sur des traitements biologiques (Boue Activée (AS), Processus Aérobie/Anoxie/Oxidation (A2O), « Sequencing batch reactor » (SBR) et procédé Ludzack-Ettinger Modifié (MLE)), où les taux d’élimination des muscs synthétiques atteignent jusqu’à ±70 %, comparativement au processus de biofiltration (BF) et au procédé de Densadeg (DE) ou moins de 40 % des muscs sont éliminés.
Les procédés chimiques (traitement au chlore (Cl) et radiation UV (UV)) ainsi que la filtration au sable (SF) sont les méthodes les plus inefficaces, avec un taux moyen d’élimination variant entre ±1-7 %.
Les concentrations retrouvées dans les rivières dépendent essentiellement de la distance entre les sites de prélèvements et les usines d’épurations les plus proches. La saison pendant laquelle le prélèvement des échantillons est effectué joue également un rôle sur les concentrations, comme le démontrent les résultats d’une publication de 2010, où les données obtenues varient énormément entre les prélèvements effectués au mois d’octobre et ceux du mois d’avril suivant. Finalement, la quantité de matière organique pouvant accumuler biologiquement ce type de composé pourra aussi jouer un rôle sur la quantité totale dissoute retrouvée dans les échantillons.
Méthodes analytiques
Eau de surface, eau d’égouts, nappe phréatique, etc.
Environ 0,5 L à 1,0 L d'échantillons sont prélevés dans des bouteilles ambrées préalablement nettoyées et séchées. Ce prénettoyage est effectué en lavant tout d'abord la bouteille à l'eau chaude en présence d'un détergent ne contenant pas de muscs. La bouteille est ensuite rincée à l'eau déionisée à au moins trois reprises. Elle est ensuite séchée pendant 4 heures à 450 degrés Celsius. Finalement, la bouteille est rincée avec un solvant de haute pureté, tel que de l'acétone ou de l'hexane, juste avant l'utilisation.
Un étalon interne est ensuite ajouté à l'échantillon. Plusieurs choix s'offrent quant à l'étalon interne. Certaines sources utilisent des dérivés deutérés de muscs synthétiques, tel que le AHTN-D3 et le musc xylène-D15. Cependant des problèmes de surévaluation de l'échantillon peuvent survenir dans l'utilisation de ces composés. Il est donc plus recommandé d'utiliser des muscs synthétiques ayant été retirés du marché, tel que le Versalide (ATTN), abandonné en 1995.
L'échantillon est ensuite filtré sur un filtre de 0,20 µm, afin d'éliminer les particules en suspension pouvant se trouver dans l'échantillon. Il est à noter qu'au lieu d'une filtration, il est également possible de procéder par centrifugation et de prélever seulement une partie du surnageant.
L'échantillon est par la suite préconcentré. L’extraction SPE est un incontournable dans la préparation des échantillons d’eau, bien que d'autres techniques existent. Cette technique permet entre autres de purifier et de préconcentrer l’échantillon avant son analyse tout en minimisant les pertes reliées à la manipulation de l'échantillon.
La plupart des publications consultée optent pour un sorbant en phase inverse (C18, XAD-2, Oasis HLB, etc.)[7]. Ces sorbants sont hydrophobes et permettent d’adsorber les composés organiques solubles provenant tant de phases aqueuses ou organiques.
Tout d'abord, le conditionnement de la phase solide ce fait généralement avec quelques millilitres d'eau déionisée ou de méthanol de haute pureté (grade HPLC). L'échantillon est ensuite élué à travers la cartouche SPE, à débit constant d'environ 2-4 ml/min. L'élution subséquente des composés retenus sur la phase stationnaire se fait avec des solvants de grade HPLC, tel que l'hexane, l'acétone, le dichlorométhane, le méthanol et l'acétonitrile.
Méthodes d'analyses par chromatographie couplée à un spectromètre de masse
Les méthodes chromatographiques (HPLC-MS, GC-MS) sont les méthodes principalement employées dans le cadre de la détection et la quantification des muscs synthétiques dans l’environnement, ainsi que pour la détermination des quantités présentes dans les échantillons biologiques (plasma sanguin, graisses animales, lait maternel, etc.)[8] - [9] - [10] - [11] - [12] - [13] - [14] - [15] - [16]. Il semble qu'étant donné le caractère volatil des muscs synthétiques, ainsi que leurs stabilités à haute température, l'analyse par GC-MS semble priorisé dans la majorité des cas. Cette méthode présente comme avantage la possibilité d'obtenir d'excellentes résolutions entre les divers composés. De plus, la limite de détection (LOD) et de quantification (LOQ) est de l'ordre des ng/L[17] - [18] - [19] - [20] - [21] - [22] - [23] - [24] - [25].
Paramètres d'analyses:
Chromatographe en phase gazeuse: Agilent 7890 series (Agilent Technologies, Santa Clara, CA),
Détecteur: Agilent 5975 "mass-selective"
Logiciel: Agilent MSD ChemStation software (E.0200.493 Version).
Colonne: Colonne capillaire Agilent HP-5MSi (5 % biphenyl/95 % dimethylsiloxane), 15 m × 0,25 mm i.d., 0,25 µm, couplé à un restricteur de silice fondue désactivée (0,171 m × 0,120 mm i.d., 0,1 µm)
Volume d'injection: 10 µl
Gaz vecteur: Hélium
Gradient de température:
| Étape | Température initiale (◦C) | Température finale (◦C) | Temps de maintien (minute) | Taux (◦C/minute) |
|---|---|---|---|---|
| 1 | 70 | 70 | 1 | 0 |
| 2 | 70 | 150 | 0 | 50 |
| 3 | 150 | 200 | 0 | 6 |
| 4 | 200 | 280 | 5 | 16 |
| post-run | 290 | 290 | 5 | 0 |
Écotoxicologie
Diverses études ont été menées sur les muscs synthétiques afin de déterminer l’impact environnemental de l’utilisation intensive de ces substances. Dans la majorité des cas, la LC50 déterminée est de loin supérieure (100 fois et plus) à la concentration retrouvée dans l’environnement.
Ce sont plutôt les effets collatéraux qui seraient plus alarmants pour l’environnement. Ainsi, chez certaines espèces de poissons, les muscs synthétiques auraient pour effets d’inhiber le 17β-estradiol sur les récepteurs d’estrogènes, empêchant ainsi le développement normal des larves. D’autres effets ont également été observés, tels qu’une diminution de la croissance ainsi qu’une augmentation d’absorption vis-à-vis d’autres composés toxiques, due à la perte de défenses multixénobiotique[26].
Toxicologie
Les articles portant sur les effets sur la santé des muscs synthétiques rapportent qu’une exposition à long terme (2 ans) au musc xylène chez le rat serait à l’origine d’une croissance accrue d’adénome hépatocellulaire et de carcinome. Une étude menée en 2004 par la HERA (Human and Environmental Risk Assesment on ingredients of household cleaning products) conclut que l’utilisation du AHTN et de HHBC ne présente pas de risque significatif sur la santé humaine, étant donné une marge de sécurité d’un facteur d’environ 75 000 entre la dose utilisée dans les produits nettoyants domestiques et la dose critique de toxicité. Une étude similaire sur le Habanolide menée par le gouvernement australien en 1998 stipule que « étant donné que les parfums incorporant l’Habanolide sont à des concentrations inférieures à 1 %, combiné à la nature non toxique du composé chimique minimise la possibilité d’effets sur la santé.».
Notes et références
- Regueiro J., Llompart M., Garcia-Jares C. & Cela R., J. Chromatogr. A, 2007, 1174, 112-124
- Regueiro J., Llompart M., Garcia-Jares C., Lamas P. J. & Cela R., J. Chromatogr. A, 2009, 1216, 2805-2815
- Rubinfeld A. S. & Luthy R., Chemosphere, 2008, 73, 873-879
- Reiner L. J., Wong M. C., Arcaro F. K. & Kannan K., Environ. Eng. Sci., 2007, 41, 3815-3820
- Bester K., J. Chromatogr. A, 2009, 1216, 470-480
- Peck M. A. & Hornbuckle C. K., J. Environ. Monit., 2006, 8, 874-879
- Pietrogrande C. M. & Basaglia G., Trends Anal. Chem., 2007, 26, 1086-1094
- Gomez J.M., Gomez-Ramos M.M., Aguera A., Mezcua M., Herrera S. & Fernandez- Alba R.A., J. Chromatogr. A, 2009, 1216, 4071-4082
- Xie Z. & Ebinghaus R., Anal. Chim. Acta, 2008, 610, 156-178
- Peck M. A., Anal. Bioanal. Chem., 2006, 386, 907-939
- Hutter P. H., Wallner P., Moshammer H., Hartl W., Satterlberg R., Lorbeer G. & Kundi M., Chemosphere, 2005, 59, 487-492
- Xu J., Wu L. & Chang C. A., Chemosphere, 2009, 77, 1299-1305
- Sumner R. N., Guitart C., Fuentes G. & Readman W. J., Environmental Pollution, 2010, 158, 215-222
- Zeng X., Sheng G., Gui H., Chen D., Shao W. & Fu J., Chemosphere, 2007, 69, 1305-1311
- Lv Y., Yuan T., Hu J. & Wang W., Analytical Sciences, 2009,25, 1125-1130
- Peck M. A. & Kucklick R. J., Anal. Bioanal. Chem., 2007, 387, 2381-2388
- Smyth A. S., Lishman L., Alaee M., Kleywegt S., Svoboda L., Yang J-J., Lee H-B. & Seto P., Chemosphere, 2007, 67, 267-275
- Smyth A. S., Lishman L., McBean A. E., Kleywegt S., Svoboda L., Yang J-J., Lee H-B. & Seto P., Environ. Eng. Sci., 2008, 7, 299-317
- Peck M. A., Linebaugh K. E. & Hornbuckle C. K., Environ. Eng. Sci., 2006, 40, 5629-5635
- Bester K. & Chen X., Anal. Bioanal. Chem., 2009, 395, 1877-1884
- Yoon Y., Ryu J., Oh J., Choi B-G. & Snyder A.S., Science of the Total Environment, 2010, 408, 636-643
- Quednow K. & Püttmann W., Clean Journal, 2008, 36, 70-77
- Peck M. A. & Hornbuckle C. K., Atmospheric Environment, 2006, 40, 6101-6111
- Shek M. W., Murphy B. M., Lam C. W. J. & Lam K. S. P., Chemosphere, 2008, 71, 1241-1250
- Lignell S., Darnerud O. P., Aune M., Cnattingius S., Hajslova J., Setkova L. & Glynn A., Environ. Eng. Sci., 2008, 42, 6743-6748
- Schnell S., Martin-Skilton R., Fernandes D. & Porte C., Environ. Sci. Technol., 2009, 43, 9458-9464