Monoxyde de dichlore
Le monoxyde de dichlore est un composé inorganique de formule brute Cl2O. Présent à température ambiante sous la forme d'un gaz brun-jaune, il possède des propriétés oxydantes et est utilisé comme agent chlorant en chimie organique.
| Monoxyde de dichlore | ||

| ||
 | ||
| Identification | ||
|---|---|---|
| No CAS | ||
| No ECHA | 100.029.312 | |
| No CE | 232-243-5 | |
| PubChem | 24646 | |
| ChEBI | 30198 | |
| SMILES | ||
| InChI | ||
| Apparence | gaz brun-jaune | |
| Propriétés chimiques | ||
| Formule | Cl2O [Isomères] |
|
| Masse molaire[1] | 86,905 ± 0,004 g/mol Cl 81,59 %, O 18,41 %, |
|
| Propriétés physiques | ||
| T° ébullition | 3,85 °C | |
| Précautions | ||
| NFPA 704[2] | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
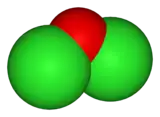
Apparence et structure
Le monoxyde de dichlore est un gaz brun-jaune à température ambiante[3]. Sa température d'ébullition est de 277 K[3].
La molécule de monoxyde de dichlore est coudée. Les liaisons Cl-O sont longues de 170 pm et l'angle entre ces liaisons est de 111°[3].
Obtention
Le monoxyde de dichlore pourrait être obtenu en faisant réagir le dichlore avec de l'oxyde de mercure(II)[3] ou du carbonate de sodium anhydre[3].
Utilisations
Le monoxyde de dichlore explose lorsqu'on le chauffe[3]. Par conséquent, il est classé au niveau 3 dans l'échelle d'instabilité de la nomenclature NFPA 704[2].
Le monoxyde de dichlore est utilisé pour le traitement des piscines, le blanchiment du bois et comme biocide[2].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Chlorine monoxide », sur Cameo chimicals (consulté le ).
- Housecroft et Sharpe 2010, p. 551
Bibliographie
- Catherine Housecroft et Alan Sharpe (trad. André Pousse), Chimie inorganique, De Boeck, , 1134 p. (ISBN 978-2-8041-6218-4, lire en ligne)
