MOPS (tampon)
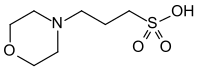
MOPS est le nom courant de l'acide 3-morpholino-1-propanesulfonique. C'est un composé faisant partie des tampons de Good[2], qui en a proposé le nom et l'usage en 1972. Sa structure chimique comporte un anneau morpholine, son pKa de 7,15 à 20 °C présente un net intérêt pour des applications en biochimie. Des 20 tampons de Good, c'est l'un des trois seuls à ne pratiquement pas complexer les métaux, ce qui évite des interférences. Le MES (pKa = 6,15) présente une structure similaire, avec un résidu éthanesulfonique plutôt que propanesulfonique.
| MOPS (tampon) | |
| |
| Identification | |
|---|---|
| Nom UICPA | Acide 3-morpholino-1-propanesulfonique |
| No CAS | |
| No ECHA | 100.013.162 |
| Propriétés chimiques | |
| Formule | C7H15NO4S |
| Masse molaire[1] | 209,263 ± 0,013 g/mol C 40,18 %, H 7,22 %, N 6,69 %, O 30,58 %, S 15,32 %, |
| pKa | 7,15 à 20 °C |
| Unités du SI et CNTP, sauf indication contraire. | |
Applications
Le MOPS est utilisé comme tampon en biologie et biochimie. Le pH d'une solution préparée avec du MOPS dépend de la concentration et de la température, un effet que l'on peut prédire et calculer[3]. Le MOPS est très soluble dans l'eau.
Faisant partie des tampons de Good, il répond à plusieurs des caractéristiques que celui-ci recherchait : il est très soluble, son pKa le rend adapté à un usage en biologie, il est chimiquement stable et peu sujet à des réactions enzymatiques, présente une absorption négligeable dans le visible et le proche UV, et sa synthèse est relativement aisée. Il est très peu complexant[4]. Il a été testé et recommandé pour l'électrophorèse sur gel de polyacrylamide[5]. L'utilisation à des concentrations supérieures à 20 mM est déconseillée pour la culture de cellules de mammifères[6].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- N.E. Good et S. Izawa, [3] Hydrogen ion buffers (DOI 10.1016/0076-6879(72)24054-x, lire en ligne), p. 53–68
- « Biological buffers », REACH Devices
- A. Kandegedara et D. B. Rorabacher, « Noncomplexing Tertiary Amines as "Better" Buffers Covering the Range of pH 3−11. Temperature Dependence of Their Acid Dissociation Constants », Anal. Chem., vol. 71, , p. 3140–3144 (PMID 21662904, DOI 10.1021/ac9902594)
- J Thomas et ME Hodes, « A new discontinuous buffer system for the electrophoresis of cationic proteins at near-neutral pH », Analytical Biochemistry, vol. 118, no 1, , p. 194–6 (PMID 6278979, DOI 10.1016/0003-2697(81)90178-0)
- H. Eagle, « Buffer Combinations for Mammalian Cell Culture », Science, vol. 174, no 4008, , p. 500–3 (PMID 5110427, DOI 10.1126/science.174.4008.500)