Méthyllysine
Une méthyllysine est un dérivé méthylé de la lysine, laquelle est un acide aminé protéinogène. Les méthyllysines se forment à la suite d'une modification post-traductionnelle de certaines protéines, sous l'effet d'enzymes appelées protéine-lysine N-méthyltransférases (EC ) apparentées aux histone méthyltransférases.
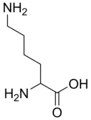
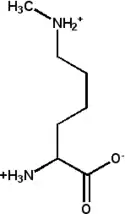
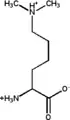 N6,N6-Diméthyl-L-lysine
N6,N6-Diméthyl-L-lysine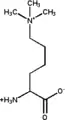 N6,N6,N6-Triméthyl-L-lysine
N6,N6,N6-Triméthyl-L-lysine
Les résidus méthylés de lysine jouent un rôle important dans la régulation épigénétique de l'expression génétique. La méthylation de résidus de lysine spécifiques de certaines histones d'un nucléosome pourrait modifier les interactions de ces histones avec l'ADN environnant ce qui modifierait à son tour l'expression des gènes portés par cet ADN. En effet, les groupes méthyle sont plus gros que les atomes d'hydrogène qu'ils remplacent, de sorte que leur présence affaiblit les interactions électrostatiques entre le squelette de l'ADN, porteur d'une charge électrique négative au niveau de chacune de ses liaisons phosphodiester –PO4−–, et les résidus de lysine des histones, porteurs chacun d'une charge électrique positive au niveau du groupe ammonium –NH3+. De plus, les groupes méthyle sont hydrophobes, ce qui modifie la distribution des molécules d'eau en leur voisinage[1] - [2].
Il est possible cependant que la méthylation des histones (en) ne modifie pas directement leur interaction avec l'ADN mais agisse plutôt en facilitant le recrutement d'autres protéines modulant la structure de la chromatine[3].
Notes et références
- Alexander J. Ruthenburg, C. David Allis et Joanna Wysocka, « Methylation of lysine 4 on histone H3: intricacy of writing and reading a single epigenetic mark », Molecular Cell, vol. 25, no 1, , p. 15–30 (ISSN 1097-2765, PMID 17218268, DOI 10.1016/j.molcel.2006.12.014, lire en ligne, consulté le )
- Wolfgang Fischle, Yanming Wang, Steven A. Jacobs et Youngchang Kim, « Molecular basis for the discrimination of repressive methyl-lysine marks in histone H3 by Polycomb and HP1 chromodomains », Genes & Development, vol. 17, no 15, , p. 1870–1881 (ISSN 0890-9369, PMID 12897054, PMCID PMC196235, DOI 10.1101/gad.1110503, lire en ligne, consulté le )
- (en) Cheryl H. Arrowsmith, Chas Bountra, Paul V. Fish, Kevin Lee et Matthieu Schapira, « Epigenetic protein families: a new frontier for drug discovery », Nature Reviews Drug Discovery, vol. 11, no 5, , p. 384-400 (PMID 22498752, DOI 10.1038/nrd3674, lire en ligne)