Insertion cotraductionnelle des protéines membranaires
L'insertion cotraductionnelle des protéines membranaires permet l'insertion d'une protéine dans une membrane au cours de sa traduction. Ce processus permet uniquement à la formation de protéines à hélices α transmembranaires. L'insertion membranaire des protéines monotopiques ou des protéines à tonneau β transmembranaire se fait par des mécanismes post-traductionnels, de même que pour certaines protéines à hélices α transmembranaires.
Insertion cotraductionnelle des protéines membranaires de type I
Étape 1 : Reconnaissance du peptide signal par la SRP

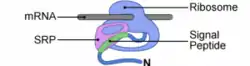
L'insertion cotraductionnelle se déroule à proximité de la membrane du Réticulum Endoplasmique (RE) chez les eucaryotes (de la membrane plasmique chez les procaryotes). La traduction des protéines membranaires de type I commence dans le cytosol par une séquence N-terminale particulière appelée peptide signal (PS). Le PS est reconnu par SRP (Signal Recognition Particule) dès sa sortie du ribosome. SRP se fixe au PS et au ribosome sur le site A de la GSU, stoppant temporairement la traduction.
Étape 2 : Fixation du ribosome sur son récepteur
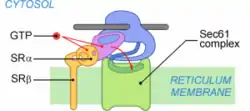
Le PS reconnu, la protéine est adressée à la membrane. Chez les mammifères, SRP est reconnue par SR (SRP Receptor), un récepteur membranaire du réticulum. L'interaction SRP-SR est régulée par le GTP. La fixation de GTP sur SRP54 permet la dissociation de SRP et du PS[1]. La fixation d'un GTP sur la sous-unité SRα stabilise l'ancrage SRP-SR. La déstabilisation du complexe SRP-PS est compensée par l'ancrage du ribosome (par sa grande sous-unité) au complexe de translocation, ou translocon.
Translocation
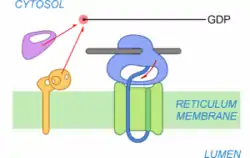
Le transfert à travers la membrane du RE commence. Dans un premier temps, le peptide signal est reconnu par le translocon entraînant son ouverture. Il sert donc de signal de transfert.
Séparation SRP/SR
Le complexe SRP-SR se dissocie du ribosome. SRP se dissocie de SR après hydrolyse du GTP en GDP et devient à nouveau opérationnel. Le ribosome n’est plus bloqué et reprend la traduction de l'ARNm. Le peptide en cours de synthèse se retrouve directement orienté vers le canal du translocon.
Étape 4 : Sortie du PS
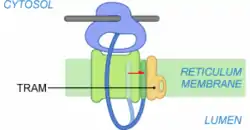
À ce stade, le ribosome est fortement lié au translocon. Le peptide signal se retrouve en contact avec le translocon et TRAM (Translocating Chain Associating Membrane protein), une glycoprotéine satellite du complexe de translocation. TRAM n'est pas systématiquement requise lors de la translocation. Elle semble tout de même souvent nécessaire à l'insertion des protéines membranaires. Le contact entre le PS et TRAM est possible grâce à une ouverture du canal formé par Sec61 sur la périphérie du translocon.
Étape 5 : Translocation co-traductionnelle
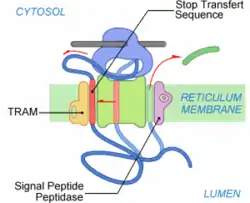
La synthèse du polypeptide continue. Elle est co-traductionnelle car elle se déroule simultanément avec la traduction. Le polypeptide est transféré à travers la membrane au fur et à mesure de son élongation jusqu'à la synthèse d'une séquence hydrophobe particulière qui bloque le transfert du polypeptide. Cette séquence est appelée Signal d'Arrêt de Transfert (SAT). Le SAT est composé d'une vingtaine de résidus hydrophobes. Grâce à son hydrophobie il suit le même chemin que le peptide signal et se retrouve en périphérie du complexe de translocation, probablement en contact avec TRAM[2] - [3]. Cette translation est possible grâce à une ouverture latérale du translocon.
Dans un même temps, le PS est clivé dès que le site de clivage est accessible à la Signal Peptidase (SPase). Le site de clivage est situé en C-terminal du PS. Le PS clivé est ensuite dégradé. On retrouve ses reliquats dans le cytosol. Pendant ce temps, la traduction continue. Le ribosome est toujours lié au translocon, mais la partie C-terminale en cours de synthèse n'est plus transférée à travers le translocon[4].
Étape 6 : Fin de la traduction
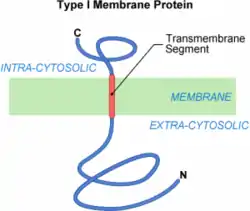
La traduction de la protéine membranaire de type I est achevée. La protéine a directement été insérée avec la bonne topologie membranaire, c’est-à-dire avec une partie N-terminal extra-cytosolique et une partie C-terminale intracytosolique. Cette insertion a emprunté la voie d'exportation des protéines sécrétées dans le milieu extérieur. Elle a nécessité en plus une séquence hydrophobe, la SAT, permettant l'insertion de la protéine dans le milieu membranaire. La SAT constitue donc l'ancrage membranaire de la protéine. L'insertion cotraductionnelle peut finalement être considérée comme un transfert partiel. Mais il faut savoir que le translocon possède d'autres capacités. Il peut, par exemple, fonctionner dans le sens inverse et renvoyer des protéines en cours de transfert vers le cytosol. On parle alors de retrotranslocation[5]. La translocation cotraductionnelle est donc un mécanisme très souple et sans doute très finement régulé par la cellule.
Insertion cotraductionnelle des protéines membranaires de type II et III
Peptide signal de type II et III
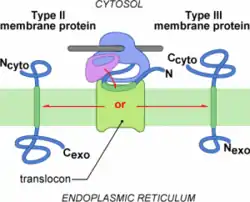
L'insertion cotraductionelle des protéines membranaires de type II et III utilise également le complexe de translocation. C'est le peptide signal qui est différent car il est responsable à la fois de l'adressage au translocon et de l'ancrage membranaire. Ce Peptide Signal ne possède pas de site de clivage comme dans les cas des protéines de type I. Il est généralement plus long (de 18 à 25 résidus essentiellement apolaires) puisqu'il doit être suffisamment long pour former une hélice transmembranaire[6]. De plus, le peptide signal des protéines membranaires de type II et III est positionné à l'intérieur de la séquence plutôt qu'à l'extrémité N-terminale. On parle également de Signal d'Ancrage pour désigner le Peptide Signal des protéines de type II et III.
Mais quelle est la différence entre les protéines membranaires de type II et de type III ? En fait, le signal d'ancrage de type II induit une translocation C-terminale, comme dans le cas du peptide signal de type I. En revanche, le signal d'ancrage de type III induit une translocation N-terminale. On parle alors de signal d'ancrage reverse.
Règle du positif à l'intérieur
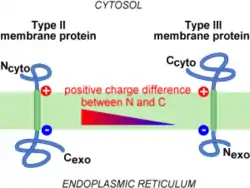
Le déterminant le mieux connu de l'orientation du Signal d'Ancrage est la distribution des charges à proximité immédiate du cœur hydrophobe du signal. C'est la règle du positive inside (positif à l'intérieur). Autrement dit, les résidus basiques sont statistiquement quatre fois plus abondants du côté cytoplasmique que du côté périplasmique chez les bactéries[7]. La corrélation inverse existe aussi pour les résidus acides (plus de résidus acides dans les segments périsplasmiques), bien que moins marquée. La règle du « positive-inside » se vérifie aussi avec les protéines membranaire du Réticulum Endoplasmique, du chloroplaste et de la mitochondrie[8] - [9].
Dans le cas de l'insertion cotraductionnelle, c'est plutôt la différence de charge de part et d'autre du cœur hydrophobe qui guide l'orientation de l'insertion. C'est le côté le plus positif qui est généralement cytoplasmique[10]. Il est donc possible l'orientation du signal en modifiant Ses charges flanquantes[11] - [12]. Le changement d'orientation ne touche le plus souvent qu'une partie des protéines produites. Cela signifie tout simplement que la distribution des charges n'est pas le seul déterminant de la topologie membranaire. positive inside rule
Quels sont les facteurs responsables de la règle du « positive inside » ? La réponse n'est pas encore clairement établie à l'heure actuelle. Il est certain que les phospholipides ont une influence importante sur la translocation mais il est difficile de connaître leur rôle exact dans l'orientation des peptides lors de la translocation. Il a été démontré que les phospholipides anioniques pouvaient retenir les charges positives des peptides signaux procaryotes et empêcher leur translocation, suggérant une interaction peptide-lipide directe[13]. Des facteurs protéines interviennent probablement aussi. Récemment, il a été démontré que Sec61p (chez Saccharomyces cerevisiae) contribuait à l'orientation du peptide signal probablement par des interactions de type électrostatique[14]. Il semble que les charges positives puissent directement avec les phospholipides chargés négativement dans le cas des procaryotes[13].
Hydrophobie du signal
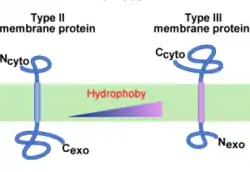
De manière générale, plus le signal d'ancrage est hydrophobe, plus la translocation est N-terminale, i.e. l'insertion est de type III[15]. Un signal d'ancrage suffisamment hydrophobe peut même outrepasser la règle du « positive inside »[16].
Comment l'hydrophobie du signal intervient dans la topologie membranaire ? Il a été proposé que ce soit un gradient apolaire, plutôt qu'une hydrophobie globale, qui intervienne dans l'orientation du signal[17]. Apparemment, un signal plus hydrophobe sur la fin est plus efficacement transloqué. Cela peut suggérer l'existence d'un site d'ancrage du signal dans le translocon plus hydrophobe du côté extracytoplasmique[15].
Repliement du domaine N-terminal
Dans le cas des protéines de type II et III, un segment N-terminal est généralement synthétisé avant le peptide signal. Le repliement d'un domaine N-terminal peut donc interférer avec la translocation à travers le translocon et favoriser la rétention de la partie N-terminale dans le cytosol[18]. Ainsi, beaucoup de protéines de type III n'ont pas réellement de domaine structural en N-terminal afin de faciliter la translocation. Dans les autres cas, il est possible que des chaperons interviennent pour empêcher un repliement stable.
Références
- (en) Miller JD, Wilhelm H, Gierasch L, Gilmore R, Walter P. (1993) GTP binding and hydrolysis by the signal recognition particle during initiation of protein translocation, Nature, vol. 366:351-354 pp.
- (en) Mothes W, Heinrich SU, Graf R, Nilsson I, von Heijne G, Brunner J, Rapoport TA (1997) Molecular mechanism of membraneprotein integration into the endoplasmic reticulum, Cell, vol. 89(4):523-533 pp.
- (en) Do H, Falcone D, Lin J, Andrews DW, Johnson AE. (1996) The cotranslational integration of membrane proteins into the phospholipid bilayer is a multistep process, Cell, vol. 85:369-378 pp.
- (en) Heinrich SU, Mothes W, Brunner J, Rapoport TA. (2000) The Sec61p complex mediates the integration of a membrane protein by allowing lipid partitioning of the transmembrane domain, Cell, vol. 102:233-244 pp.
- Johnson AE, Haigh NG. (2000) The ER translocon and retrotranslocation: is the shift into reverse manual or automatic?, Cell, vol. 102:709-712 pp.
- (en) Goder, V., Spiess, M. (2001) Topogenesis of membrane proteins: determinants and dynamics, FEBS Lett., vol. 504:87-93 pp.
- (en) von Heijne, G. (1986) Net N-C charge imbalance may be important for signal sequence function in bacteria, J. Mol. Biol., vol. 192:287-290 pp.
- (en) von Heijne, G. (1992) Membrane protein structure prediction. Hydrophobicity analysis and the positive-inside rule, J. Mol. Biol., vol. 225:487-494 pp.
- (en) Wallin, E., von Heijne, G. (1998) Genome-wide analysis of integral membrane proteins from eubacterial, archaean, and eukaryotic organisms, Protein Sci., vol. 7:1029-1038 pp.
- (en) Hartmann, E., Rapoport, T.A., Lodish, H.F. (1989) Predicting the orientation of eukaryotic membrane-spanning proteins, Proc. Natl. Acad. Sci. USA, vol. 86:5786-5790 pp.
- (en) Parks GD, Lamb RA. (1993) Role of NH2-terminal positively charged residues in establishing membrane protein topology, J. Biol. Chem., vol. 268:19101-19109 pp.
- (en) Rutz, C., Rosenthal W., Schulein, R. (1999) A single negatively charged residue affects the orientation of a membrane protein in the inner membrane of Escherichia coli only when it is located adjacent to a transmembrane domain., J. Biol. Chem., vol. 274:33757-33763.
- (en) van Klompenburg W, Nilsson I, von Heijne G, de Kruijff B. (1998) Anionic phospholipids are determinants of membrane protein topology, EMBO J., vol. 16:4261-4266.
- (en) Goder, V., Junne, T., Spiess, M. (2003) Sec61p contributes to signal sequence orientation according to the positive-inside rule, Mol. Biol. Cell., vol. 15:1470-1478 pp.
- (en) Goder, V., Spiess, M. (2003) Molecular mechanism of signal sequence orientation in the endoplasmic reticulum, EMBO J., vol. 22:3645-3653 pp.
- (en) Rosch, K., Naeher, D., Laird, V., Goder, V., Spiess, M. (2000) The topogenic contribution of uncharged amino acids on signal sequence orientation in the endoplasmic reticulum, J. Biol. Chem., vol. 275:14916-14922 pp.
- (en) Harley, C.A., Holt, J.A., Turner, R., Tipper, D.J. (1998) Transmembrane protein insertion orientation in yeast depends on the charge difference across transmembrane segments, their total hydrophobicity, and its distribution, J. Biol. Chem., vol. 273:24963-24971 pp.
- (en) Denzer, A.J., Nabholz, C.E., Spiess M. (1995) Transmembrane orientation of signal-anchor proteins is affected by the folding state but not the size of the N-terminal domain, EMBO J., 'vol. 14:6311-6317 pp.