Histopathologie du cholestéatome
L’histopathologie du cholestéatome est un outil décisif du diagnostic d'une « tumeur » ou plutôt d'une néoformation bénigne de l'oreille moyenne.
Introduction
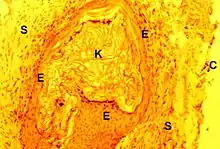
Le cholestéatome peut être défini comme un kyste épidermique occupant l'oreille moyenne ou comme une forme d'otite chronique avec présence d'épithélium pavimenteux stratifié dans l'oreille moyenne. Il est rarement congénital : le tympan est alors intact. Beaucoup plus souvent, il résulte d'une invasion de la caisse par l'épiderme du tympan (oreille externe), que cet épithélium se soit invaginé à la faveur d'une rétraction tympanique totale (Schappnel) ou qu'il y ait pénétré par une perforation marginale.
Il se présente dans la caisse comme un « sac » extensif dont la paroi ou « matrix » (Bremond & al., 1980[1]) se compose, sur le plan histologique, d’un épithélium malpighien producteur de kératine et d'un stroma conjonctif. Sa cavité contient cette même kératine et non du cholestérol, de sorte que le nom même de "cholestéatome" est inapproprié.
Ce sac présente un danger pour l'oreille moyenne et même la chaîne des osselets, agressivité destructrice est liée à la présence anormale dans la caisse du tympan de l'épithélium malpighien, kératinisé, donc pourvu d'un stratum granulosum , à l’otite chronique moyenne cholestéatomateuse dont il est plus ou moins directement responsable et surtout, à un ensemble d’autres lésions associées ou « satellites ».
Stimulant et aggravant la maladie, ces dernières dimposent une exérèse chirurgicale du cholestéatome aussi large que possible[2] - [3]).
Le diagnostic définitif ne peut être assuré que par la seule histologie ou anatomo-pathologie.
Structure histologique du cholestéatome
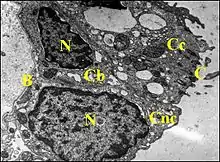
Normalement, la cavité tympanique de l'oreille moyenne est bordée par une tunique muqueuse montrant un épithélium et un stroma ou lamina propria. que sépare une lame basale. Cette muqueuse enveloppe aussi les trois osselets (marteau, enclume, étrier) et leurs ligaments, donc toute la chaine ossiculaire. L'épithélium est un revêtement simple, pavimenteux à cuboïdal, avec quelques plages pseudo-stratifiées autour de l'orifice de la trompe d'Eustache et de l'insertion du tympan. Il se compose de cellules ciliées, sécrétrices, non ciliées et basales, bien visibles au microscope électronique à transmission.
Cette structure est hautement caractéristique (André Lopez) et évite de confondre le cholestéatome avec d'autres lésions de caisse, tumorales ou pseudotumorales, dans le cadre d'un diagnostic différentiel.
Contenu du « sac »
Il est formé par un matériel éosinophile de nature kératinique, squameux et généralement anucléé sauf lorsqu'il existe une parakératose dans l'épithélium pariétal sous-jacent. Des noyaux aplatis et pycnotiques sont alors visibles dans une zone limitée. Il se mêle parfois à la kératine des polynucléaires et des histiocytes plus ou moins fusionnés en cellules géantes (symplasmes). Ces macrophages tendent à englober les lamelles cornées. Ils sont souvent l’indice de discontinuités dans la paroi du « sac » dont ils proviennent et peuvent aussi traduire la présence d’un granulome à kératine sous-jacent.
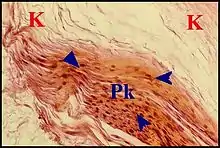
Paroi du « sac »
Désignée tout entière sous le nom de « matrice » par certains auteurs[1], elle présente un aspect histologique rappelant beaucoup celui décrit pour la poche de rétraction. Les deux lésions ne se distinguent classiquement que par des particularités évolutives et structurales mineures qui leur sont propres[4].
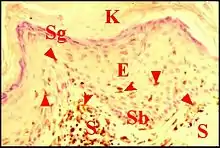
Épithélium du « sac »
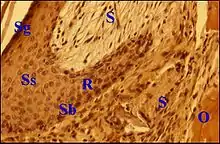
Cet épithélium, auquel d'autres auteurs réservent le nom de « matrix »[5], est formé comme par 4 strates ou couches caractéristiques comme dans un épiderme normal : le stratum basale (couche germinative, basal layer) reposant sur une lame basale ; le stratum spinosum (couche des cellules à épines, prickle cell layer ) ; le stratum granulosum (couche granuleuse, granular layer) ; le stratum corneum (couche cornée, horny layer).
Bien que ce dernier soit généralement orthokératosique, il peut y persister de noyaux pycnotiques (parakératose) ; le stratum granulosum a alors disparu dans la partie sous-jacente du corps muqueux de Malpighi. Il se présente comme un revêtement assez mince et régulier, pourvu de crêtes (epidermal ridges) lorsqu'il n'est pas altéré. Ces crêtes caractérisent l’épiderme normal et s’engrènent avec les papilles du derme sous-jacent.
Le front de progression cholestéatomateux offre un profil cunéiforme caractéristique et se substitue progressivement à l'épithélium cubique de caisse.
Aux mêmes niveaux et surtout au-dessus de foyers inflammatoires pouvant former un granulome lorsqu'ils sont particulièrement denses, l’épithélium présente des modifications localisées importantes : exosérose ou œdème intercellulaire, spongiose et œdème cellulaire, disparition du stratum granulosum et exocytose (migration) de polynucléaires. Il existe aussi un afflux de cellules de Langerhans que révèlent l’antigène commun leucocytaire, la vimentine, et surtout, la protéine S100.
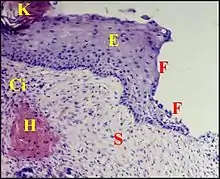
Stroma du sac
Le stroma est un tissu conjonctif anormal développé à partir de celui de la muqueuse de caisse et, plus précisément, de la lamina propria sensu lato de l'oreille moyenne, y compris la couche fibreuse du marteau. Ne présentant donc aucun rapport avec le derme, il a été désigné par ailleurs sous les noms de « tissu sous-épithélial »[6] ou de « perimatrix »[5].
Outre les cellules habituellement présentes dans le conjonctif de caisse, le stroma peut renfermer des éléments allongés, isolés ou réunis en faisceaux, ayant l'aspect de fibroblastes mais exprimant non seulement la vimentine mais aussi l'actine musculaire lisse (A.M.L.) comme la paroi des capillaires sanguins. Ils peuvent donc être interprétés comme des myofibroblastes dont la présence dans la caisse (anciens greffons veineux) lors de la chirurgie de l'otospongiose a été d'ailleurs démontrée[7]).
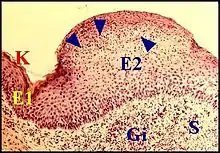
Lésions associées au cholestéatome
Ces lésions affectent essentiellement la composante conjonctive ou stroma, et, sous ce dernier, peuvent s'étendre à la chaine des osselets y provoquant des lésions ossiculaires.
Généralités
Bien que parmi ces lésions satellites la tympanosclérose et le granulome à cholestérol puissent être suspectés lors de l’intervention chirurgicale, leur taille est le plus souvent microscopique et ne permet de les identifier qu’histologiquement.
Elles sont toutes de nature inflammatoire, soit spontanées, soit iatrogènes en cas de récidive cholestéatomateuse. On ne peut les dissocier de l'otite chronique moyenne dont l’épithélium malpighien kératinisé est plus ou moins directement responsable. En revanche, elles facilitent la progression de ce dernier par le jeu des interactions mésenchymo-épithéliales et suscitent aussi une hyperplasie pseudo-glandulaire de l'épithélium de caisse là où il subsiste. Il s'ensuit que les lésions associées au cholestéatome sont des facteurs qui stimulent et aggravent la maladie : leur exérèse chirurgicale est donc impérative.
Les unes, comme la tympanosclérose, ont été sous-estimées dans les statistiques, et d’autres, comme le granulome mixte et le granulome à kératine , généralement ignorées. Ces derniers entrent dans le cadre des granulomes macrophagiques, incluant aussi certains granulomes à corps étrangers, dits antixéniques et à copeaux osseux. Ils sont iatrogènes, c'est-à-dire post-opératoires ou consécutifs à un traitement local, tout comme un cas exceptionnel de névrome de caisse envahissant.
Otite moyenne
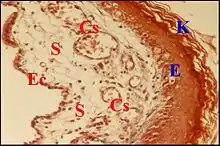
_dans_un_cholest%C3%A9atome.jpg.webp)
Lésion prédominante, elle est caractérisée au début par un simple œdème du stroma et une vaso-dilatation de ses capillaires. Un infiltrat inflammatoire non spécifique apparait ensuite dans le même stroma. Cet infiltrat se compose de polynucléaires neutrophiles, lymphocytes B, plasmocytes, mastocytes et histiocytes. Il peut former un ou plusieurs foyers granulomateux avec des capillaires néoformés, des fibroblastes et des hémorragies localisées.Des polynucléaires et cellules de Langherans en émigrent vers l’épithélium malpighien sus-jacent où leurs vimentine et proteine S100 permettent de bien les mettre en évidence. L’afflux de ces cellules inflammatoires peut entrainer des ruptures épithéliales spontanées (ulcérations) et confirme leur agressivité envers le revêtement malpighien[8].
Le stroma granulomateux ainsi mis à nu peut s’épaissir en un ou plusieurs bourgeons charnus dont la protrusion forme un « polype otique » ou « aural ». Localisée ou diffuse, modérée ou sévère, l’inflammation ne se limite pas aux zones évolutives du cholestéatome[8]). De plus, elle peut affecter la chaine ossiculaire sous-jacente et, dans certains cas, les prothèses qui y ont été insérées.
Hyperplasie pseudo-glandulaire
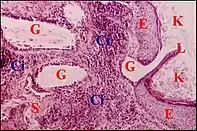
Observée dans 53 % des, elle est reconnaissable à des cryptes glanduliformes formées par un épithélium prismatique du type « respiratoire » modifié. Ces structures sont bien mises en évidence par les techniques histochimiques (PAS, bleu alcian) colorant leur produit de sécrétion et surtout, par le marquage des cytokératines de leur épithélium. Lorsque les « ostia » sont obturés, elles subissent souvent une transformation kystique avec amincissement de l’épithélium, rétention de mucus et afflux de macrophages, parfois aussi de polynucléaires qui les convertissent en micro-abcès. De plus, une métaplasie épithéliale malpighienne ou épidermoïde est (rarement) possible.
Tympanosclérose
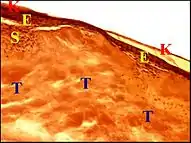
Elle peut être définie comme une transformation fibreuse du stroma évoluant vers la scléro-hyalinisation qui en est caractéristique. Cette lésion est un tissu conjonctif d'abord jeune, renfermant encore des fibroblastes, puis presque acellulaire, dense et homogène ou lamelleux, se calcifiant fréquemment (dépôts calciques basophiles) et pouvant subir aussi une métaplasie ou métamorphose osseuse. Siégeant assez souvent au voisinage des granulomes macrophagiques et pouvant s'intriquer aussi avec une hyperplasie pseudo-glandulaire, elle représente jusqu'à 40 % des cas[2] - [3].
Granulomes macrophagiques
Essentiellement formés par un amas de macrophages se fusionnant en cellules géantes (symplasmes) pourvues de nombreux noyaux, donc multinucléées, ils résultent d’une stimulation locale du stroma. Elle peut être due, soit à des corps étrangers iatrogènes qu’une précédente intervention a introduit dans l’oreille moyenne, soit aux productions pathologiques de cette dernière : kératine du cholestéatome et dépôts de cholestérol. Il s'y associe des infiltrats inflammatoires granulomateux banals à cellules rondes (lymphocytes, plasmocytes) et une vasodilatation des capillaires sanguins plus ou moins marquée.
Les cellules géantes sont du type antixénique. Par leur coloration, leur nombre et la disposition des noyaux, elles se différencient des cellules de Langhans (tuberculose), des ostéoclastes ou myéloplaxes qui sont pourvus d’une « bordure en brosse » (microvilli) et des symplasmes de la maladie de Wegener.
Granulome à cholestérol
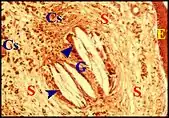
Déjà reconnu macroscopiquement par sa couleur dans une douzaine de cas, il montre toujours les constituants habituels de ce type de lésion : fentes aciculaires ou en forme de cigare correspondant à des cristaux cholestéroliques dissous lors de la préparation des coupes (images négatives) ; macrophages et cellules géantes entourant ces cavités. De plus, les capillaires sanguins sont souvent dilatés et à l'origine de foyers hémorragiques. La désintégration de ces derniers est responsable de dépôts d’hémosidérine, granuleux et brun-jaunâtre, se colorant par la technique de Perls au bleu de Prusse. Il peut survenir aussi une hyalinisation homogène et faiblement éosinophile du stroma conjonctif séparant les fentes aciculaires. Le granulome à cholestérol est présent dans 23,5 % des observations.
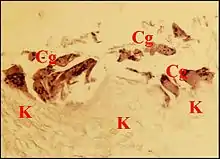
Granulome à kératine.
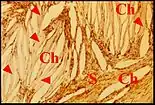
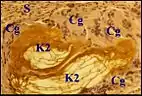
Il est dû à l'implantation du contenu cholestéatomateux dans le stroma. Faiblement biréfringent en lumière polarisée, ce matériel inclus est surtout reconnaissable à ses squames acidophiles marquées par les anticorps antikératine et à la réaction qu'il suscite dans le stroma. Les lamelles sont phagocytées individuellement par les macrophages ou, plus souvent, logées dans des cavités arrondies ou irrégulières qu'entourent des cellules géantes multinucléées. L'implantation de la kératine affecte un stroma dénudé, soit par lyse du revêtement cubique de caisse en avant du front de progression cholestéatomateux, soit au niveau des brèches de l'épithélium malpighien, qu'elles soient spontanées, ou provoquées dans la récidive de cholestéatome. Cette implantation semble être facilitée par le tissu de granulation préexistant, l'œdème et la vaso-dilatation.
Granulome mixte
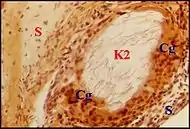
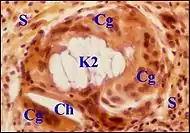
Dans cette lésion intéressante (28 cas parmi les granulomes à cholestérol et à kératine), les cristaux cholestéroliques s'associent avec du matériel corné. Une réaction macrophagique gigantocellulaire commune englobe à la fois des squames de kératine, dans leurs espaces irréguliers ou arrondis, parfois très étendus, et les fentes à cholestérol, plus géométriques. Ces inclusions peuvent être très rapprochées et entourées pat des symplasmes accolés, lorsque le foyer, d'étendue très réduite, constitue un microgranulome.
Le cholestérol y dérive manifestement de la kératine voisine désintégrée. La relation est moins évidente lorsque les foyers sont de plus grande taille et paraissent seulement juxtaposés, avec un simple rapport de contiguïté. Une association est possible avec la tympanosclérose. Des lipophages à cytoplasme clair, spumeux, et à petit noyau arrondi, sont une composante de l'infiltrat inflammatoire. Ils se rencontrent aussi dans le granulome à kératine.
Granulomes à corps étrangers (G. antixéniques)
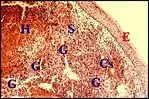
Ils peuvent être soupçonnés lorsque dans un cholestéatome déjà traité, la réaction macrophagique s’organise autour d’inclusions différant des cristaux aciculaires cholestéroliques et des squames de kératine. Ces inclusions sont souvent difficiles à voir en lumière normale dans les coupes histologiques car elles présentent un aspect vitreux ou cristallin, avec des contours irréguliers, incurvés ou linéaires. Leur nature étrangère est, en revanche, bien reconnaissable à la forte biréfringence qu'elle manifeste en lumière polarisée. Il s’agit le plus souvent de dépôts d’antibiotiques ou de corticoïdes, de fils de compresse (« textilome »), de débris de verre ou d’enduit de spéculum, beaucoup plus rarement (2 cas) d’une prothèse mise en place antérieurement pour otospongiose et fragmentée dans le stroma du cholestéatome qui l'englobe. Les granulomes antixéniques peuvent d’ailleurs coexister avec d’autres lésions associées telles que celui à cholestérol.
Copeaux osseux

Il s'agit de spicules irréguliers d'os nécrobiotique trouvés dans des cholestéatomes récidivés. Ces esquilles sont incluses en plein stroma, à distance des osselets, mais peuvent cependant soulever l’épithélium malpighien sus-jacent. Elles peuvent y susciter une réaction fibro-inflammatoire parfois accompagnée de cellules géantes d’aspect ostéoclastique et, dans certains cas, une ossification métaplasique secondaire évocatrice de tympanosclérose sur le plan clinique uniquement.
Névrome de caisse

Chez un patient, il a été observé l'association d'un névrome, vraisemblablement iatrogène, avec un cholestéatome récidivé. Siégeant dans le stroma et pénétrant même dans un osselet sous-jacent, cette néoformation était constituée par des fascicules de fibres nerveuses enchevêtrés et s'intriquant d'ailleurs avec des pseudo-glandes ainsi qu'un granulome à cholestérol. L'intense positivité d'une recherche histoimmunologique de la neurone estérase spécifique a confirmé la nature exacte de cette lésion.
Lésions ossiculaires


_dans_un_cholest%C3%A9atome.jpg.webp)
Toutes les lésions ci-dessus affectent essentiellement la composante conjonctive ou stroma, et, sous ce dernier, peuvent s'étendre à la chaine des osselets y provoquant des remaniements.
Dans les lésions ossiculaires associées au cholestéatome c’est le processus inflammatoire de l'otite chronique moyenne qui est en cause tout comme dans d’autres états pathologiques nécessitant une révision de caisse.
Dans les osselets normaux, les espaces périvasculaires, en continuité avec le stroma de la muqueuse, et les cavités médullaires centrales, non élargis sont seulement occupés par un tissu conjonctif peu abondant avec quelques adipocytes. L'os périosté et endochondral adjacent montre des systèmes haversiens bien formés et non modifiés.
Dans les osselets lésés, il existe une nette prédominance pour l'enclume que pourraient expliquer sa structure ajourée particulière, un apport sanguin plus exposé et peut être aussi l'absence de revêtement cartilagineux.
Les modifications peuvent affecter la surface ossiculaire, la profondeur ou les deux, leur aspect variant inexplicablement de l'enclume au marteau dans une même oreille et souvent aussi d'une partie à l'autre du même osselet. Le tissu osseux haversien est plus ou moins largement résorbé dans une majorité d'osselets (90 %), en surface, juste au-dessous des tissus environnants, et aussi en profondeur, tout autour des espaces péri-vasculaires. Une reconstruction évidente par ostéogénèse lamellaire et (ou) membraneuse s’associe fréquemment avec la destruction osseuse, créant ainsi des aspects en mosaïque. La nécrose basophile est une lésion rare déjà signalée dans la série de Grippaudo[9]).
Globuli interossei
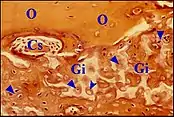
Connus depuis les travaux de Manasse (1897[10]), ces vestiges de cartilage embryonnaire ou immature retrouvés dans la couche moyenne endochondrale de la capsule otique, sont des îlots de grosses cellules arrondies, d’aspect chondrocytaire que séparent des lacunes polycycliques. Leur transformation en os ne serait pas due à une métaplasie des chondrocytes mais plutôt à des cellules spéciales entourant les capillaires sanguins, envahissant les lacunes, devenant des ostéoblastes puis des ostéocytes et produisant la matrice de l’os. Ils peuvent être à l’origine de foyers d’otospongiose et fragilisent aussi les osselets dans d’autres lésions.
Rapports avec l'épithélium malpighien
Lorsque l'os est tapissé en surface par l'épithélium malpighien du cholestéatome , il peut ne pas affecter ce dernier, le soulever ou même le transpercer dans le cas d'une ostéolyse particulièrement intense.
Ostéolyse et inflammation
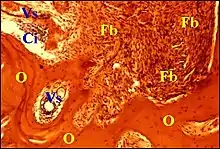
Les espaces sont irrégulièrement élargis et semblent englober parfois des globuli interossei qui pourraient les avoir fragilisés. Bordés par des travées osseuses plus ou moins déchiquetées, ils montrent un tissu conjonctif abondant, en continuité avec le stroma de surface (muqueuse de caisse ou cholestéatome), une dilatation marquée des capillaires sanguins (congestion ou hyperhémie) et de petits infiltrats inflammatoires non spécifiques à cellules rondes (lymphocytes, plasmocytes, histiocytes) formant souvent autour d'eux des manchons périvasculaires. Il a été rarement observé (15 osselets) un infiltrat inflammatoire beaucoup plus dense et étendu, polymorphe, avec des polynucléaires, occupant largement les espaces périvasculaires, réalisant une véritable ostéite et pouvant correspondre à la lésion que quelques auteurs tels que Sadé et al.[11] considèrent comme une ostéomyélite résorbante. Chez l'un des patients, HIV +, les délabrements de l'os étaient tels qu'il s'en était détaché des séquestres, l'un d'eux transperçant même l'épithélium malpighien du cholestéatome sus-jacent. Un véritable tissu de granulation n'a été observé que deux fois, à la surface des osselets en résorption mais jamais dans leur profondeur. En revanche, il a été relevé un granulome mixte et quatre cas de granulomes à kératine logé dans des espaces périvasculaires largement ouverts. Englobant des squames cornées et (ou) des dépôts cholestéroliques, leurs cellules géantes (symplasmes) étaient séparées par des fibroblastes de l'os érodé adjacent.
Remaniements du conjonctif
Le tissu conjonctif remplissant les espaces est souvent lâche, d'aspect œdémateux, constitué par une substance fondamentale très claire, par des fibres collagènes, et par des fibroblastes, ces derniers plus ou moins groupés autour des vaisseaux sanguins ou près de l'os, l'ensemble constituant une fibrose plus ou moins dense. Ces cellules sont marquées par leur vimentine mais peuvent aussi exprimer l'actine musculaire lisse, indice d'une possible différenciation en myofibroblastes comme dans les greffes veineuses lors de la chirurgie de l'otospongiose [7]). Fait remarquable, elles sont susceptibles de proliférer densément comme Harris[12]) l'a observé dans du matériel osseux temporal et des osselets. Dans 5 des cas observés, la prolifération était même si active qu'un véritable tissu fibromateux agressif en faisceaux détruisait l'os sur une grande étendue.
Pénétration de tissus étrangers
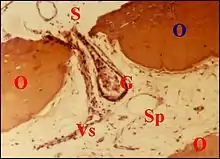
L'invasion ossiculaire par des tissus extraosseux (étrangers) provenant de l'oreille moyenne est facilitée non seulement par l'ostéolyse mais aussi, et surtout, par la continuité existant entre le stroma de la caisse ou du cholestéatome et les espaces péri-vasculaires. Il n'a pas été observé d'épithélium malpighien cholestéatomateux inclus.
Structures glanduliformes
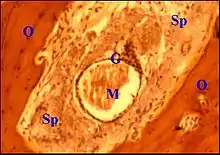
Des structures glanduliformes ou pseudo-glandes étaient présentes dans les espaces péri-vasculaires de 50 osselets. Décrites pour la première fois par Sadé[13]), ces cryptes sont issues de l'épithélium de caisse hyperplasié (otite moyenne simple) ou des pseudo-glandes provenant de ce même épithélium et associées au cholestéatome.Leur épithélium simple est plus ou moins aplati. Leur lumière peut renfermer des histiocytes, des cellules desquamées, ainsi que du mucus colorable par le bleu alcian. Elles subissaient parfois une distension kystique, au point même d'occuper la quasi-totalité de l'espace péri-vasculaire. Dans l'un des cas observés, elles se moulaient sur l'os adjacent et paraissaient ainsi « ballonisées ».
Tissu nerveux
Dans le cas exceptionnel de névrome de caisse signalé ci-dessus, des filets nerveux occupaient le stroma du cholestéatome et pénétraient aussi dans l'osselet sous-jacent fragilisé. Ils en empruntaient les espaces, s'y enchevêtrant avec des capillaires sanguins.
Diagnostics différentiels
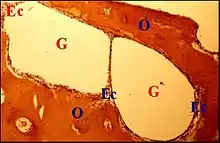
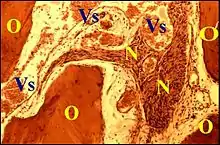
Avec son aspect de « kyste » à contenu « pailleté », le cholestéatome réalise un tableau clinique évocateur permettant de l'identifier lors de l'exérèse. Toutefois, un examen histologique complet de la pièce s'avère indispensable pour confirmer sa nature, évaluer les lésions associées et ne pas le confondre avec les autres néoformations de l'oreille moyenne. De même, les lésions associées au cholestéatome ne doivent pas prêter à confusion avec d'autres pathologies microscopiques réactionnelles de l'oreille moyenne. Il y a d'ailleurs généralement possibilité de rencontrer ces dernières en l'absence de tout cholestéatome homolatéral. Elles sont infectieuses ou iatrogènes et accompagnent alors du matériel prothétique et se présentent comme des granulomes giganto-cellulaires.
Les tumeurs de l'oreille moyenne
Ces dernières peuvent être des « classiques » de la chirurgie O.R.L. (tumeur glomique, schwannome) ou rarissimes tels que deux cas de papillome et de choristome relevés dans la série de chirurgie de la caisse[2] - [3], grandes surprises du diagnostic microscopique.
La tumeur glomique
Elle est constituée, sur le plan histologique, par un réseau dense de capillaires sanguins sinusoïdes à paroi mince que souligne l'actine musculaire lisse de sa composante contractile, et par des amas cellulaires arrondis (« Zellballen ») de structure glomérulaire ou alvéolaire. Leurs cellules ont un noyau vésiculeux arrondi, à nucléole très apparent, et un cytoplasme granuleux clair ou éosinophile. La dénomination usitée est celle de paragangliome, définissant la tumeur qui se développe aux dépens des paraganglions (Zellballen ou cluster).
Le schwannome (neurinome)
C’est une tumeur bénigne (dans la très grande majorité des cas) qui se développe aux dépens des cellules dites de Schwann (du nom de l’auteur qui les a décrites). Ces cellules constituent la gaine des nerfs périphériques. Au sein de l’oreille moyenne, les deux nerfs pouvant donner naissance à des schwannomes sont le nerf facial (Nerf crânien #7) et ses branches intra tympaniques (corde du tympan, nerf du muscle stapédien) et le nerf de Jacobson qui est une petite branche du nerf glosso-pharyngien (nerf crânien # 9). Les schwannomes du nerf facial bien que rares sont plus fréquents que les schwannomes du Jacobson[14]. Les signes fonctionnels sont les mêmes que pour le cholestéatome (surdité, acouphènes, vertiges) mais on ne retrouve pas d’écoulement d’oreille. De plus, une atteinte faciale est plus fréquente que dans les cholestéatomes primitifs.
Le choristome
Les choristomes ou hétérotopies sont des néoformations bénignes de nature malformative constituées par des tissus de structure normale ou subnormale sur le plan microscopique, mais dont la localisation est aberrante. Ils se situent en effet dans des endroits du corps où ils ne devraient pas se trouver normalement et sont, de ce fait, des hétérotopies. C'est ainsi que l'une d'elles, cutanée et salivaire localisée dans la caisse du tympan a pu être diagnostiquée cliniquement comme un cholestéatome avant que l'examen histologique ne révèle sa vraie nature.
La tuberculose (Bacillose)
Le seul cas rencontré dans la série type de Lopez & al.[3] - [2] est reconnaissable à des foyers inflammatoires granulomateux d'aspect tuberculoïde spécifique, siégeant dans le stroma de la muqueuse. Ces foyers montrent en coupe une nécrose d'homogénéisation centrale, un bandeau de cellules épithélioïdes et, plus en périphérie, des cellules géantes mutinuclées (symplasmes) dites de Langhans. Des cellules inflammatoires rondes, surtout lymphocytaires, sont également visibles. Comme l'ont souligné d'autres auteurs, il s'agit là d'une affection très rare de l'oreille moyenne, à diagnostic plus histologique que bactériologique.
Les réactions à corps étrangers
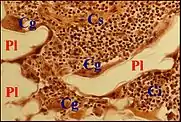

Elles peuvent être provoquées par des fils de compresse (textilome) inclus dans le stroma lors d'une première intervention (cholestéatome récidivé) ou par des fragments de prothèse mise en place avant l'apparition indépendante du cholestéatome. Ces derniers matériaux (Téflon, Polycel), utilisés dans la chirurgie de la surdité, peuvent susciter des foyers inflammatoires granulomateux de composition cellulaire bariolée mais comportant toujours de grands symplasmes antixéniques multinucléés. Rappelant ceux du granulome à kératine, ils résultent également de la fusion de macrophages et s'accolent au matériel étranger fragmenté qu'ils tendent à englober.
Dans les deux cas, les corps étrangers sont ternes et peu visibles dans les coupes histologiques avec un éclairement normal mais bien révélés par la lumière polarisée du fait de leur biréfringence.
Commentaires
La paroi du cholestéatome
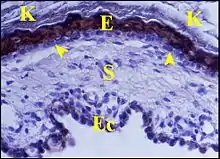
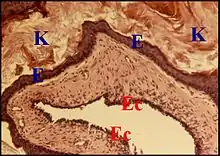
L’épithélium malpighien du cholestéatome est un épiderme véritable par sa structure histologique et par la présence des cellules de Langherans caractéristiques de la peau[1]. Il est identique au revêtement externe du tympan et à celui du conduit auditif, eux aussi dépourvus ou presque des crêtes profondes (epidermal ridges) qui caractérisent l’épiderme dans son ensemble et s’engrènent avec les papilles du derme sous-jacent.
Le stroma en revanche ne dérive pas du derme mais est fourni par la lamina propria sensu lato de l’oreille moyenne, couche fibreuse tympanique comprise. En effet, il ne renferme pas d’annexes cutanées, présentes seulement dans un cas exceptionnel d'hétérotopie mixte (choristome). De plus, les deux types d’épithéliums, épidermique et de caisse, sont souvent visibles de part et d’autre du même stroma conjonctif, disposition déjà notée par d’autres auteurs mais presque sans commentaire[5] - [1] - [15]). La mise en évidence de leurs cytokératines permet de les accentuer. Elle montre alors que le cholestéatome s'est développé à partir d'une poche de rétraction qui présente au début la même structure histologique.
Il s'ensuit que le nom de « peau », trop souvent encore attribué à la « matrice » cholestéatomateuse, devrait être abandonné définitivement. L'appellation même de cholestéatome reste d'ailleurs discutable bien qu'elle ait été aussi consacrée par l'usage.
Les cryptes épithéliales
Elles sont d'authentiques structures pathologiques et non de véritables glandes qui font normalement défaut dans la muqueuse de caisse. Les pseudo-glandes résultent d'une hyperplasie mucipare mais peut-être aussi d'un enfouissement partiel de l'épithélium de caisse dans le stroma, sous la poussée de l'épiderme ou lorsque l'otite prend un caractère adhésif.
La tympanosclérose
Elle semble être une lésion beaucoup plus fréquente qu'on ne l'admet généralement. Le pourcentage des cas de la série (47 %) dépasse largement, du moins en histologie, celui qu'ont indiqué divers auteurs tels que Plester (1971 : 1 %)[16], Bremond & al. (1985 : 7 %)[17], certains d'entre eux soutenant même qu'il existe une compétition ou association négative entre cette lésion et le cholestéatome[18]).
Le granulome à kératine
Il est une entité microscopique réelle due à l'implantation de matériel corné dans le stroma où il suscite une réaction macrophagique et gigantocellulaire. Avant l'étude de Lopez & al[2] - [3] cette lésion n’est pas mentionnée dans la littérature ou seulement signalée au passage sans qu’un lien direct ne soit établi avec le cholestéatome. Le granulome à kératine peut fort bien être rattaché à une série d'affections cutanées de l'oreille externe , disparates mais comportant toujours une réaction macrophagique anti-kératine : granulome par aérateur (Hawke & Jahn, 1988)[19], kératose obturante, kystes épidermique et trichilemmal rompus dans le derme, poil inclus, follicule distendu par un comédon et même, pilomatrixome ou épithélioma momifié de Malherbe.
Le granulome mixte
Il n’était pas individualisé avant les recherches. Le voisinage étroit des squames cornées et des dépôts de cholestérol suggère qu'il pourrait dériver, du moins en partie, des produits lipidiques de la kératine détruite. Cette hypothèse est basée sur la fréquence des lipophages dans les granulomes mixtes, à kératine, et, par ailleurs, sur l'observation de cristaux de cholestérol dans les kystes épidermiques et les cryptes amygdaliennes kystifiées.
L'origine du cholestérol
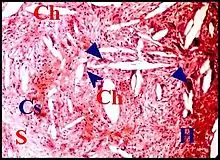
La même hypothèse s'accorde avec une origine tissulaire du cholestérol[20]) et n'exclue d'ailleurs pas que ce dernier soit également issu d'hématies désintégrées[15] - [21] - [22]). Une preuve en est apportée par les capillaires sanguins dilatés et les suffusions hémorragiques ainsi que les dépôts d'hémosidérine, mis en évidence par la réaction de Perls, quasi constants dans les granulomes à cholestérol « purs » du matériel étudié.
Considérations pathogéniques
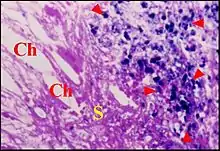
Au point de vue pathogénique, les observations microscopiques de Lopez & al.[2] - [3] ne confirment ni la théorie d’une métaplasie épidermoïde affectant l’épithélium cubique de caisse[23]), exception faite pour deux cas douteux ni celle d’une prolifération papillaire profonde de l’épiderme tympanique[24]). Elles sont plutôt en faveur de la théorie de l’immigration, plus précisément de l’invagination tympanique ou poche de rétraction. L’épithélium cubique de caisse tapissant le revers du stroma semble en être une meilleure preuve que la persistance occasionnelle de fibres élastiques. On a tenté d'établir des critères de différence entre la poche de rétraction et le cholestéatome avéré. Il ne s'agit en fait que de particularités évolutives et structurales mineures[4])
En ce qui concerne les lésions ossiculaires, l'importance de la destruction qu'elles déterminent domine les problèmes de physiopathologie dans l'otite chronique moyenne, surtout lorsque cette dernière accompagne un cholestéatome. De nombreuses théories, souvent divergentes ou complémentaires, ont tenté d'établir un rapport entre l'ostéolyse et un environnement inflammatoire, suggérant alors plus ou moins un mécanisme cytochimique. Divers auteurs évoquent une résorption ostéoclastique ou non ostéoclastique par l'intermédiaire des cytokines ou d'une activité enzymatique, quel que soit d'ailleurs le facteur déclenchant en cause : pression que l'épithélium malpighien cholestéatomateux exerce sur l'os[24], phénomène de contact superficiel, sécrétion épithéliale, libération de débris kératiniques[25] et surtout, inflammation des tissus environnants.
Dans leurs études, ces mêmes auteurs ne précisent pas toujours la nature de l'os lésé : parois de l'oreille moyenne ou osselets. Les recherches précédentes sont en désaccord avec la mention d'une ostéoclasie fréquente par Grippaudo[9], Pollock[26], Huang et al.[27]. Il n'a été observé des cellules géantes multinuclées d'aspect ostéoclastique (Ostéoclastes ou myéloplaxes) que dans trois cas seulement : elles siégeaient au voisinage immédiat ou au contact de travées osseuses érodées. Au moins dans les osselets, les observations semblent donc bien confirmer l'absence ou l'extrême rareté des ostéoclastes telle que l'ont soulignée plusieurs chercheurs (Thomsen &t al., 1974 ; Karaja, 1976 ; Bernstein & al., 1977; Tanaka & al., 1980 ; Kaneko & al., 1980[25] ; Schaper et Van de Heyning, 1980 ; Breatlau & al., 1981 ; Man n & al., 1981 ; Chao & Jin, 1992).
Il faut souligner le rôle de l'hyperhémie et de la prolifération fibroblastique. Déjà signalée par Thomsen et al. (1974), l'hyperhémie est un état pionnier qui s'associe fréquemment avec une ostéolyse dans les espaces périvasculaires où il n'y a pas (encore) d'infiltrat inflammatoire. Elle pourrait ainsi provoquer une résorption acellulaire. La prolifération fibroblastique peut se développer d'abord superficiellement, soit dans la matrice du cholestéatome, soit, si ce dernier est absent, dans le stroma de la muqueuse, d'où elle s'étend ensuite aux espaces périvasculaires voisins. Elle peut aussi apparaitre d'emblée dans les mêmes espaces, peut être aux dépens des parois de vaisseaux. A. Lopez pense comme Harris[12] que la réaction fibroblastique est un facteur actif d'ostéolyse, peut être par les enzymes protéolytiques, dont la collagénase, que les cellules conjonctives sont censées sécréter dans l'oreille moyenne (Huang & al., 1993). Elle ne dénote pas un processus cicatriciel car elle apparait souvent de novo, en l'absence de cellules inflammatoires profondes et loin des tissus de granulation superficiels. Les lésions ossiculaires semblent donc plus liées à des réactions d'aspect inflammatoire, au sens large du terme, qu'à la présence ou non d'un épithélium malpighien épidermique dans l'oreille moyenne.
La présence des myofibroblastes, tant dans les osselets lésés que le stroma cholestéatomateux est une découverte intéressante et qui mériterait des recherches ultrastructurale et physiopathologique approfondies. Ces cellules sont également présentes dans la muqueuse de l'oreille moyenne biopsiée en chirurgie de l'otospongiose et examinées en microscopie électronique à transmission[7]. Leur ultrastructure est intermédiaire entre celles des fibroblastes (réticulum endoplasmique granuleux) et des cellules musculaires lisses (plaques denses, myofilaments, micropinocytose). Crédités de propriétés contractiles et même sécrétoires, les myofibroblastes sont retrouvés aujourd'hui avec une fréquence croissante dans divers tissus pathologiques : athérosclérose, réaction stromale des tumeurs, fasciites, cicatrisations vicieuses (Majno, 1979 ; Seemayer & al., 1981).
Incidence chirurgicale
Sur le plan pratique, l'extrême fréquence des lésions complexes du cholestéatome, leur intrication et les interactions stroma-épiderme, la menace d'une destruction ossiculaire et d'une atteinte de l'oreille interne nécessitent une exérèse aussi large que possible des tissus pathologiques dans la chirurgie de l'otite moyenne chronique. De plus, l'importance de lésions plus profondes affectant les osselets (marteau, enclume) doit limiter leur utilisation pour une ossiculoplastie lorsque l'oreille intéressée présente une otite chronique moyenne.
Notes et références
- G. Bremond, avec J. Magnan et F. Acquaviva, « Cholestéatome et métaplasie épidermoïde. Acta Otorhinolaryngol. Belg.,34 (1), p. 34-42 », Acta Otorhinolaryngol. Belg.,34 (1), p. 34-42,
- A. Lopez, avec B. Gratacap et R. Vincent, « The associated lesions of cholesteatoma. in Proceed. Fourth Intern. Conf. Cholesteatoma and Mastoid Surgery, 8-12 septembre 1993, Niigata, Japon, p. 19-25 », Proceed.Fourth Intern .Conf. Cholesteatoma and Mastoid Surgery, 8-12 septembre 1993, Niigata, Japon, p. 19-25,
- A. Lopez, avec B. Gratacap, G. Vandeventer et R. Vincent, « Les lésions associées au cholestéatome », Rev. Soc. Fr. O.R.L., no 23, 1994, p. 19-24,
- G. Zechner, « Stratified squamous epithelium in retraction pockets and attic cholesteatoma in », Sadé ed. : Proceed. IInd. intern.Conf.Cholesteatoma and Mastoid Surgery. Tel Aviv, Israël, 22-27 mars 1981, Kugler Pub. Amsterdam, p. 119-124,
- D.J. Lim, avec W.H. Saunders, « Acquired Cholesteatoma : Light and electron microscope observations », Ann.Otol.Rhinol.Laryng., 81 (no 1), p. 2-12,
- Y. Kaneko, avec R. Yuasa, I. Ise, Y. Iino, H. Shinkawa, M. Rokuyo, S. Tomioka et Y. Shibahara, « Bone destruction due to the rupture of a cholesteatoma sac : a pathogenesis of bone destruction in aural cholesteatoma », The Laryngoscope no 90, p. 1865-1871,
- A. Lopez, avec L. Juberthie-Jupeau, J-C. Olivier, J-B. Causse et J. Robinson, « Survival and evolution of vein grafts in otoslerosis surgery : structural and ultrastructural evidence », The Amer.Journ. of Otology, 13, no 2, mars 1992, p. 173-184,
- D. Mayot, avec M.C. Bene, C. Perrin, G.C. Faure et M. Wayoff, « Nouvelles conceptions de l'évolution du cholestéatome à partir de l'étude immuno-histologique de 96 prélèvements », Ann.Oto-laryng.(Paris), 108, p. 382-388,
- M. Grippaudo, « Histopathological studies of the ossicles in chronic otitis media. », J Laryngol Otol. 72, 3, p. 177–189,
- P. Manasse, « Über knorpelhaltige Interglobularräume in der menschlichen Labyrinthkapsel », Z Ohrenheilkd, 31, p. 1–22,
- J. Sadé, E. Berco, D. Buyanover, et M. Brown, « Ossicular damages in chronic middle-ear inflammation », Acta Otolaryngol.(Stockh.) 92, p. 273-283,
- A.J. Harris, « Cholesteatosis and chronic otitis media. The histopathology of osseous and soft tissues. », Laryngoscope 72: 954–980.,
- J. Sade, « Epithelial invasion of intraossicular spaces », J Laryngol Otol. 86, 1, p. 15–21,
- K. Aydin et al., AJNR Am J Neuroradiol, 2000 ; A. Karandikar et al., Singapore Med J, 2014
- I. Friedmann, The Ear, Edimbourg, Londres, Melbourne, New-York, Churchill Livingstone., Part Five in W.St C.Symmers : Systemic pathology, Vol.1 : Nose, Throat and Ears.
- D. Plester, « Tympanosclerosis », J.Otolaryng.Soc.Australia, 3, p. 325-326,
- Bremond,G. avec G.Bonnaud et J.Magnan, « La tympanosclérose », Encycl.Med.Chir.(Paris, France), Oto-rhino-laryngologie, 20182 G, 10 mai 1985, p. 1-8,
- R.E. Gristwood, avec W.N. Venables, « Cholesteatoma and tympanosclerosis », Proceed.IInd.Intern.Conf.Cholesteatoma and Mastoid Surgery. Tel Aviv, Israël, 22-27 mars 1981, Kugler Pub., Amsterdam, p. 133-137,
- M. Hawke, avec A.F. Jahn, « Diseases of the ear. Clinical and pathological aspects. Lippincott Comp., Philadelphia and Gower Med.Pub., New-York, Londres », Diseases of the ear. Clinical and pathological aspects. Lippincott Comp., Philadelphia and Gower Med.Pub., New-York, Londres,
- J. Sadé et A. Teitz, « Cholesterol in cholesteatoma and in the otitis media syndrome », in J. Sadé ed. : Proceed. IInd. Intern. Conf. Colesteatoma and and Mastoid Surgery. Tel Aviv, Israël, 22-27 mars 1981, Kugler Pub.,Amsterdam, p. 125-132,
- L. Michaels et H. B. Hellquist, « Ear. in », Ear, Nose and Throat Histopathology. Springer Verlag, London, 551 pp.,
- I. Friedmann et W. Arnold, « The cholesteatoma in », Pathology of the Ear. Churchill - Livingstone. Edimbourg, Londres, Madrid.,
- J. Sadé, avec A. Babyatzki & G. Pinkus, « The metaplastic and congenital origin of cholesteatoma in », J. Sadé ed. : Proceed.IInd.Intern.Conf.Colesteatoma and and Mastoid Surgery. Tel Aviv, Israël, 22-27 mars 1981, Kugler Pub., Amsterdam, p. 305-319,
- L. Ruedi, « Pathogenesis and surgical treatment of the middle ear cholesteatoma. », Acta Otolaryngol (Stockh) Suppl 361, p. 1-45,
- Y. Kaneko, R. Yuasa, I. Ise, Y. Iino, H. Shinkawa, M. Rokuyo, S. Tomioka et Y. Shibahara, « Bone destruction due to the rupture of a cholesteatoma sac : a pathogenesis of bone destruction in aural cholesteatoma », The Laryngoscope, 90, p. 1865-1871,
- F.J. Pollock, « Pathology of ossicles in chronic otitis media », Arch Otolaryngol 70, p. 421–435,
- C.C. Huang, O. Fujioka, T.Y. Huang, et J.M. Ahn, « Bone resorbing factors in cholesteatoma », Proceed.Fourth Intern.Conf. Cholesteatoma and Mastoid Surgery, 8-12 septembre 1992, Niigata, Japon, p. 127-131,