Hexoxyde de dichlore
L'hexoxyde de dichlore est un composé inorganique de formule brute Cl2O6. Il existe à température ambiante sous la forme d'un liquide rouge foncé.
| Hexoxyde de dichlore | |
| |
| Identification | |
|---|---|
| No CAS | [1] |
| Apparence | liquide rouge foncé |
| Propriétés chimiques | |
| Formule | Cl2O6 [Isomères] |
| Masse molaire[2] | 166,902 ± 0,006 g/mol Cl 42,48 %, O 57,52 %, |
| Propriétés physiques | |
| T° fusion | 3,5 °C |
| T° ébullition | environ 200 °C |
| Unités du SI et CNTP, sauf indication contraire. | |
Apparence et structure
Le monoxyde de dichlore est un liquide rouge foncé à température ambiante[3]. Sa température de fusion est de 3,5 °C et sa température d'ébullition est d'environ 200 °C[1].
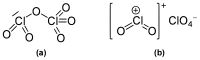
La molécule d'hexoxyde de dichlore présente deux centres Cl non-équivalents[3]. Cette espèce peut-être vue comme l'anhydride mixte de l'acide chlorique et de l'acide perchlorique[3]. Lorsqu'il se trouve sous forme solide, il a tendance à se scinder en un ion perchlorate et en un ion ClO2+[3].
Obtention
L'hexoxyde de dichlore peut être obtenu par action de l'ozone sur le monoxyde de dichlore[3].
Une autre méthode de préparation est la réaction entre l'acide perchlorique et le fluorure de chloryle[3] :
- ClO2F + HClO4 → Cl2O6 + HF
Propriétés et utilisations
L'hexoxyde de dichlore est instable[3] et explose au contact d'espèces organiques[4].
L'hexoxyde de dichlore s'hydrolyse pour former de l'acide perchlorique et de l'acide chlorique[3].
Notes et références
- Haynes 2015, p. 4.58
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Housecroft et Sharpe 2010, p. 551
- Chapman et Hall 1992, p. 2897
Bibliographie
- Catherine Housecroft et Alan Sharpe (trad. de l'anglais par André Pousse), Chimie inorganique, Bruxelles/Paris, De Boeck, , 1097 p. (ISBN 978-2-8041-6218-4, lire en ligne)
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, CRC press, , 96e éd.
- (en) Chapman et Hall, Dictionary of inorganic compounds, vol. 3,