Expérience de Clément-Desormes
En chimie physique, et plus particulièrement en thermodynamique, l'expérience de Clément-Desormes permet d'estimer le coefficient de Laplace d'un gaz parfait. Elle a été réalisée en 1819 par Nicolas Clément et Charles Desormes. Cette expérience présente aujourd'hui essentiellement un intérêt historique et didactique, car sa précision est médiocre ; pour mesurer le coefficient de Laplace, les méthodes fondées sur la mesure de la vitesse du son sont bien préférables[1].
Les transferts adiabatiques dans un gaz et le coefficient de Laplace
Le coefficient de Laplace est défini par :
avec :
Description de l'expérience
Appareillage

On dispose d'un récipient équipé d'une vanne, couplé à un manomètre et rempli du gaz à étudier sous la pression ambiante . Le manomètre peut être à mercure, ou encore à eau ce qui le rend 13,6 fois plus sensible. Dans le second cas on utilise des variations de pression plus faibles.
Mesure
Le manomètre étant au zéro on crée d'abord dans le récipient une petite surpression et on attend que l'équilibre thermique du gaz soit rétabli. On repère alors l'élévation du niveau du manomètre.
On ouvre la vanne ce qui évacue du gaz en surpression et on la referme aussitôt. La pression étant retombée à la valeur le manomètre se remet à zéro. Or le gaz a été refroidi par la détente et il revient ensuite à la température ambiante, d'où une remontée du manomètre et une dénivellation finale .
Expression de γ
Pour obtenir l'expression de on utilise le diagramme de Clapeyron en coordonnées (schéma au paragraphe suivant, mais pour une compression) et on note :
- le point représentant l'état initial ;
- le point après la détente adiabatique ;
- le point final (lorsque le système s'est rééquilibré thermiquement avec l'extérieur) .
Comme le segment est une adiabatique, et que et sont sur une même isotherme, on a respectivement d'après la loi de Laplace et la loi des gaz parfaits :
Et donc,
Comme :
D'où l'expression de :
L'expérience originale de 1819
Résultats
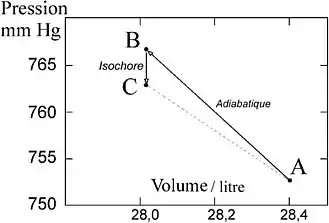
En 1819, Nicolas Clément et Charles Desormes publient les données détaillées de l'expérience qu'ils ont conçue[2] et qui donnera lieu par la suite à des développements théoriques importants. Au lieu de comprimer l'air contenu dans un ballon comme dans l'exemple précédent ils commencent par le détendre de 2 % environ. En faisant entrer un instant de l'air dans le ballon ils y rétablissent la pression ambiante. Cette compression adiabatique échauffe aussitôt le gaz, qui ensuite se remet peu à peu à la température ambiante ce qui abaisse légèrement sa pression.
Les valeurs mesurées par Clément et Desormes sont les suivantes :
- température et pression ambiantes : 12,5 °C et 766,5 mmHg ;
- volume du récipient : 28,40 l ;
- pression initiale dans le ballon : 752,69 mmHg ;
- après recompression adiabatique, pression : 766,5 mmHg ;
- après retour à 12,5 °C, pression : 762,89 mmHg.
De ces résultats on tire les valeurs = −13,81 mmHg et = −3,61 mmHg. La formule précédente donne = 1,35.
Discussion des résultats
Cette valeur est un peu inférieure à la valeur exacte 7/5 = 1,40. Les erreurs statistiques liées aux mesures de pression ne permettraient pas d'expliquer cet écart. Il s'agit ici d'une erreur systématique du fait que la compression n'est pas totalement adiabatique et qu'une petite partie de la chaleur dégagée s'est communiquée au récipient dès la détente. Pour limiter les pertes de chaleur Clément et Desormes ont d'ailleurs utilisé un ballon aussi grand que possible (plus de 28 l). La valeur obtenue est d'autant plus remarquable qu'ils ne connaissaient pas la valeur prévue par la théorie cinétique des gaz.
Il est remarquable que Clément et Desormes aient utilisé la pression du gaz pour en déduire sa température. Ils ont calculé ainsi une élévation de température égale à 1,32 °C (un calcul plus précis déduit de leurs mesures mais avec le coefficient de compression des gaz exact donnerait 1,35 °C).
Notes et références
- Cf. M. Bertin, J.-P. Faroux et J. Renault, Thermodynamique, Bordas, coll. « Dunod-Université », (ISBN 2040155120), « Propriétés énergétiques des gaz parfaits », p. 154-156.
- Charles Desormes et Nicolas Clément, Journal de physique, de chimie et d'histoire naturelle, tome 89, N° 07, 1819, p.331. gallica.
Voir aussi
Articles connexes
Liens externes
- Mesure de gamma (Clément-Desormes), animation sur le site de l'université du Mans.
Bibliographie
- « Sur le calcul de C/c par la méthode dite de Clément et Desormes », R. Swyngedauw, J. Phys. Theor. Appl., 1897, 6 (1), pp.129-131.
- L’expérience de Clément et Desormes automatisée, Alain Arbouet, Bulletin de l'union des physiciens, 775, p. 1079, 1995 (UdPPC - Union des professeurs de physique et de chimie).



















