Conjugué anticorps-médicament
Les conjugués anticorps-médicaments (en anglais antibody-drug conjugates ou ADC) sont une classe de médicaments biopharmaceutiques conçus comme une thérapie ciblée pour le traitement des cancers. Contrairement à la chimiothérapie, les ADC sont conçus pour cibler et tuer les cellules tumorales tout en épargnant les cellules saines. En 2019, quelque 56 sociétés pharmaceutiques développaient des ADC[1].
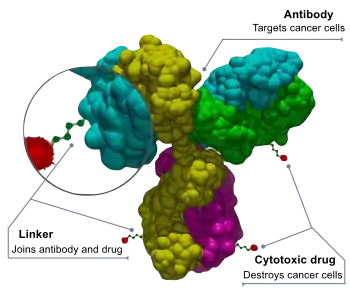
Les ADC sont des molécules complexes composées d'un anticorps lié à une charge utile ou à un médicament cytotoxique (anticancéreux) biologiquement actif[2]. Les conjugués anticorps-médicaments sont des exemples de bioconjugués et d'immunoconjugués.
Les ADC combinent les capacités de ciblage des anticorps monoclonaux et la capacité de destruction du cancer des médicaments cytotoxiques. Ils peuvent être conçus pour faire la distinction entre les tissus sains et les tissus malades[3].
Mécanisme d'action
Un médicament anticancéreux est couplé à un anticorps qui cible spécifiquement un certain antigène tumoral (par exemple, une protéine qui, idéalement, se trouve uniquement dans ou sur les cellules tumorales). Les anticorps se fixent aux antigènes à la surface des cellules cancéreuses. La réaction biochimique entre l'anticorps et la protéine cible (antigène) déclenche un signal dans la cellule tumorale, qui absorbe ou internalise l'anticorps avec la cytotoxine liée. Après internalisation de l'ADC, la cytotoxine tue la cellule cancéreuse[3]. Ce ciblage limite les effets secondaires et donne une fenêtre thérapeutique plus large que les autres agents chimiothérapeutiques.
Les technologies de ADC ont fait l'objet de nombreuses publications[4] - [5], y compris de revues scientifiques.
Historique
Les médicaments qui ciblent les cellules tumorales et en ignorent d'autres ont été conçus dès 1900 par Paul Ehrlich, lauréat allemand du prix Nobel[1].
En 2001, le médicament de Pfizer/Wyeth, Gemtuzumab ozogamicin (nom commercial : Mylotarg) a été approuvé. Cependant, à la demande de la Food and Drug Administration (FDA) des États-Unis, la société l'a retirée en juin 2010[6] et l'a réintroduite sur le marché américain en 2017[7].
Le brentuximab védotine (nom commercial : Adcetris, commercialisé par Seattle Genetics et Millennium/Takeda)[8] a été approuvé par la FDA le 19 août 2011 pour le HL récidivant et le sALCL récidivant et a reçu une autorisation de mise sur le marché conditionnelle de l'Agence européenne des médicaments en octobre 2012.
L'emtansine de trastuzumab (ado-trastuzumab emtansine ou T-DM1, nom commercial : Kadcyla, commercialisé par Genentech et Roche) a été approuvée en février 2013 pour le traitement du cancer du sein métastatique HER2-positif (CBM) chez les personnes ayant reçu un traitement antérieur par trastuzumab et une chimiothérapie par taxane[9] - [10].
La Commission européenne a approuvé l'Inotuzumab ozogamicine[11] en monothérapie pour le traitement de la leucémie lymphoblastique aiguë (LLA) précurseur des lymphocytes B CD22-positifs ou récidivants chez l'adulte le 30 juin 2017 sous le nom commercial Besponsa (Pfizer/Wyeth)[12], suivi le 17 août 2017 de la FDA[13].
Le premier conjugué anticorps-médicament immunologique (iADC), ABBV-3373, fait actuellement l'objet d'essais cliniques chez des participants atteints de polyarthrite rhumatoïde modérée à grave[14].
En 2019, AstraZeneca a accepté de verser jusqu'à 6,9 milliards de dollars américains pour développer conjointement le DS-8201, commercialisé sous le nom Enhertu, avec le japonais Daiichi Sankyo[15]. Le DS-8201 transporte huit charges utiles, contre quatre jusqu'alors[1]. En juin 2019, Daiichi Sankyo Co. fait état des succès très prometteurs des essais cliniques du médicament qui devrait être mis sur le marché d'ici la fin de l'année 2019[16]. Enhertu (Trastuzumab deruxtecan (en)) bénéficie en France d'une autorisation temporaire d'utilisation en troisième ligne[15].
Références
- Kanoko Matsuyama, « Drug to replace chemotherapy may reshape cancer care », sur BNN Bloomberg, (consulté le )
- « Antibody-Drug Conjugates Stage a Comeback »,
- Ravi V. J. Chari, Bridget A. Martell, Jonathan L. Gross, Sherrilyn B. Cook, Sudhir A. Shah, Walter A. Blättler, Sara J. McKenzie et Victor S. Goldmacher, « Immunoconjugates containing novel maytansinoids: promising anticancer drugs », Cancer Research, vol. 52, no 1, , p. 127–31 (PMID 1727373)
- , Pollack A. May 31, 2012. In print on June 1, 2012, on page B1 of the New York edition with the headline: A One-Two Punch.
- , Published June 3, 2012
- FDA: Pfizer Voluntarily Withdraws Cancer Treatment Mylotarg from U.S. Market, US FDA
- « Approved Drugs > FDA Approves Gemtuzumab Ozogamicin for CD33-positive AML », sur fda.gov, Silver Spring, USA, U.S. Food and Drug Administration, (consulté le )
- Brentuximab vedotin (SGN35), ADC Review/Journal of Antibody-drug Conjugates
- FDA Approves Genentech's Kadcyla® (Ado-Trastuzumab Emtansine), the First Antibody-Drug Conjugate for Treating Her2-Positive Metastatic Breast Cancer
- Ado-trastuzumab emtansine (U.S. Department of Health and Human Services | National Institutes of Health | National Cancer Institute.)
- Inotuzumab ozogamicin (drug description), ADC Review/Journal of Antibody-drug Conjugates
- BESPONSA® Approved in the EU for Adult Patients with Relapsed or Refractory B-cell Precursor Acute Lymphoblastic Leukemia
- U.S. FDA Approves Inotuzumab Ozogamicin for Treatment of Patients with R/R B-cell precursor Acute Lymphoblastic Leukemia, ADC Review/Journal of Antibody-drug Conjugates, August 17, 2017
- « A Study to Evaluate the Safety, Tolerability, Pharmacokinetics, and Efficacy of ABBV-3373 in Participants With Moderate to Severe Rheumatoid Arthritis - Full Text View - ClinicalTrials.gov », sur clinicaltrials.gov
- « PROTOCOLE D’UTILISATION THERAPEUTIQUE ET DE RECUEIL D’INFORMATIONS », sur ansm.sante.fr,
- (en-US) Kanoko Matsuyama, « Drug devised to replace chemotherapy may reshape cancer care », The Japan Times Online, (ISSN 0447-5763, lire en ligne, consulté le )