Bioluminescence Resonance Energy Transfer
Dans les années 1960, le Dr Osamu Shimomura mit en évidence un phénomène de bioluminescence existant chez un organisme marin, la méduse Aequorea victoria.
Quelques années plus tard l’extraction et la purification d’une protéine bioluminescente, appelée aequorine, permit de démontrer son rôle dans la luminescence naturelle de cet organisme. L’aequorine s’est révélée être par la suite un complexe moléculaire formé d’une protéine de 21 kDa ou apo-aequorine possédant trois sites de haute affinité pour le calcium, d’oxygène moléculaire et d’un chromophore, la coelenterazine (en).
Explications
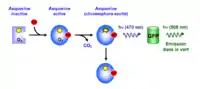
Lorsque trois ions calcium se lient à l’apo-aequorine, il se produit un changement conformationnel permettant l’oxydation de la coelenterazine en coelenteramide (en) qui se trouve alors dans un état excité. Le complexe ainsi formé est aussi appelé : blue fluorescent protein. En effet, in vitro, la réaction se termine par la libération d’une molécule de CO2 et l’émission d’une lumière bleue avec un pic à 469 nm (nm = nanomètre)[1]. Cependant, in vivo, la bioluminescence de certaines cellules de la méduse n’est pas de couleur bleue mais verte. En 1974 fut établie l’existence d’un transfert d’énergie de l’aequorine vers une protéine isolée à partir du même organisme, la GFP (Green Fluorescent Protein). L’excitation de la GFP par l’aequorine au cours du transfert d’énergie est responsable d’une émission dans le vert avec un pic à 510 nm[2] (Figure 1).
Par la suite d’autres organismes présentant des mécanismes de bioluminescence semblables ont été identifiés. Parmi ces organismes, Renilla reniformis (pensée de mer) possède une enzyme de 36 kDa, la Renilla luciférase, qui catalyse l'oxydation de la coelenterazine (luciférine) en présence d’oxygène mais sans nécessité d’un cofacteur (calcium). In vitro, cette réaction catalytique produit une lumière bleue avec un pic d'émission à 480 nm[3]. Comme pour l’aequorine, la présence d’une GFP chez Renilla Reniformis permet un transfert d’énergie qui se traduit par une émission dans le vert à 510 nm.
Utilisation du BRET en biologie
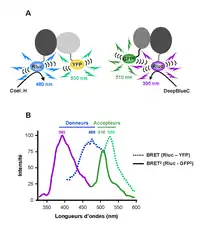
L’identification puis le clonage des protéines impliquées dans un processus naturel de BRET (cf. ci-dessus) ont permis d’adapter ce système à l’étude des protéines en cellules vivantes. La particularité du BRET vient de la nature du donneur. En effet, il s’agit d’une molécule luminescente, la coelenterazine, dont l’excitation est déclenchée par une enzyme, la Renilla Luciferase (Rluc). Comme pour le FRET, l’accepteur du BRET peut être une protéine fluorescente comme la GFP ou la YFP. Pour l’instant, le BRET est limité à des applications au format fluorimètre. En effet, l’analyse microscopique du signal de BRET est rendue difficile par la faible intensité d’émission de la Rluc.
Le BRET est un processus qui dépend entre autres, de la distance séparant le donneur de l’accepteur. Ainsi, lorsque la Rluc et la YFP se trouvent à proximité (d < 10 nm), un transfert d’énergie peut avoir lieu entre les deux molécules avec l’émission d’une fluorescence caractéristique à 530 nm (Figure 2). L’excellente compatibilité de ces deux molécules en fait un couple très utilisé pour l’étude des interactions protéiques. Pour cela, les protéines d’intérêt sont fusionnées à la Rluc ou la YFP avant d’être exprimées dans la cellule. En absence de toute interaction, l’ajout de coelenterazine sur des cellules co-exprimant les deux protéines recombinantes se traduit par un spectre d’émission avec un pic centré à 480 nm. Toutefois, si les deux protéines sont en interaction un deuxième pic caractéristique du BRET apparaît aux environs de 530 nm. Ce pic correspond à l’émission de la YFP excitée par le transfert d’énergie provenant de la réaction enzymatique.
Expérimentalement, le BRET est déterminé ratiométriquement en divisant l’émission de l’accepteur à 530 nm par l’émission du donneur à 480 nm. Ce mode ratiométrique permet d’éliminer les variations de signal dues à des fluctuations de la lumière émise (interférences optiques des milieux, variations du nombre de cellules, volume de l’essai…). De plus, l’utilisation d’une enzyme pour exciter le donneur luminescent (coelenterazine) permet de s’affranchir d’une source excitatrice extérieure évitant ainsi les problèmes de photoblanchiment des GFP, d’effet de filtre des milieux à la longueur d’onde d’excitation du donneur ou encore de l’excitation croisée de l’accepteur. Enfin, les taux d’expression relatifs des molécules peuvent être quantifiés séparément en mesurant la luminescence du donneur à 480 nm et la fluorescence de l’accepteur à 530 nm.
Cependant, comme pour le FRET, le signal sur bruit d’un essai en BRET est significativement affecté par le recouvrement des spectres d’émission du substrat de la Rluc et de la YFP. Pour cette raison, une version améliorée du BRET, nommée BRET2 a été développée[4]. Dans cette version, un analogue de la coelenterazine, le DeepBlueC, est utilisé comme substrat de la Rluc (Figure 2). Ce substrat se caractérise par une émission de fluorescence significativement décalée de 480 à 400 nm. Un accepteur nommé GFP2 a été spécialement développé afin de présenter un pic d’excitation à 400 nm et un pic d’émission à 510 nm. Ainsi, la résolution spectrale du BRET2 est significativement améliorée par rapport au BRET classique avec une séparation presque complète des spectres d’émission (déplacement de Stokes de 115 nm en BRET2 et de 50 nm en BRET standard). Le rapport déterminé dans le BRET2 (510 nm / 400 nm) présente par conséquent un bruit de fond négligeable. Néanmoins, l’utilisation du DeepBlueC comme substrat de la Rluc donne un rendement quantique (rapport du nombre de photons émis sur le nombre de photons absorbés par une molécule) beaucoup plus faible que celui de la coelenterazine. La nécessité d’avoir un lecteur sensible pour le BRET2 est une limite à l’utilisation de cette technologie.
L’approche BRET a été particulièrement utilisée pour analyser l’oligomérisation (association de protéines) et l’activation des récepteurs couplés aux protéines G (RCPG). Plus sensible que le FRET CFP/YFP et adaptable au format microplaque, le BRET est un outil de choix pour l’étude des protéines en cellules vivantes. Toutefois, comme pour le FRET, cette technologie ne permet pas de discriminer aisément le signal de BRET provenant des interactions entre les protéines de surface du signal provenant des protéines retenues dans les compartiments intracellulaires.
Notes et références
- Shimomura et Johnson, 1969
- Morise et al., 1974
- Matthews et al., 1977; Wampler et al., 1971
- Bertrand et al., 2002; Jensen et al., 2002; Vrecl et al., 2004