Béluga du Saint-Laurent
Les bélugas du fleuve Saint-Laurent sont une population de bélugas endémique à la province de Québec, isolée géographiquement des autres populations fréquentant les eaux de l'océan Arctique[1].

Cette population a vécu une pression de chasse importante jusqu'à l'adoption d'un moratoire en rapport à cette activité en 1979[2]. Depuis le début du suivi de la population en 1980, le nombre d'individus rapporté annuellement stagne autour de 600 à 800 individus[3]. Les raisons pour la situation précaire actuelle incluent la pollution anthropique telle l'utilisation passée de polluants organiques persistants (POP) avant leur bannissement comme les hydrocarbures aromatiques polycycliques (HAP)[4] et les dichlorodiphényltrichloroéthanes (DTT)[5], les pathogènes présents dans les eaux qu'ils fréquentent, la prolifération d'algues toxiques et autres dérangements causés par l'humain comme les perturbations sonores causées par les bateaux[6].
Historique et démographie
Les données historiques en lien avec le début de la chasse au béluga proviennent de lettres écrites à la main décrivant cette pêche. Les lettres les plus anciennes ont été datées à l'aube des années 1750, où la popularité de la chasse a explosé[7] - [8]. Le taux de capture à ce temps a été estimé à environ une centaine de bélugas par piège installé et pouvait atteindre jusqu'à près de 1 000 individus par saison de chasse[9]. De plus, la chasse sportive de cet animal était encouragée en offrant une compensation monétaire pour chaque queue de béluga rapportée. Cette pression de pêche était renforcée par la pensée populaire que les bélugas étaient une espèce nuisible puisqu'ils se nourrissaient de poissons convoités par la pêche commerciale[10]. Considérant que cet animal est une espèce à reproduction lente[1], les abattages reliées à cette croyance ont contribué à engendrer un impact énorme sur leur démographie. Le premier rapport constatant le déclin inévitable fut publié en 1978, un an avant l'interdiction officielle de leur pêche[11]. Ce rapport stipulait que le nombre de bélugas vivant dans l'estuaire du fleuve Saint-Laurent durant ses années oscillait entre 300 et 350 seulement[12]. Ce déclin sera confirmé par une deuxième étude réalisée en 1982[13]. En réponse aux résultats du premier rapport, en 1979, le Gouvernement du Canada agrandit l'aire protégée du béluga afin d'inclure la population de l'estuaire du Saint-Laurent[14], puis, à la suite du deuxième rapport, en 1983, lui donna officiellement le titre d'espèce menacée[15]. En 1988, un troisième rapport subséquent confirma la stagnation du nombre d'individus au cours des dix années suivant le premier rapport[16].

Suivant le changement de statut, de nombreux efforts de recensement[16] - [15] - [17] - [18] - [19] - [20] furent déployés afin de surveiller la fluctuation démographique subséquente aux mesures de protection contre la chasse mises en place par le Gouvernement du Canada. Malgré ceux-ci, le nombre de bélugas a continué de stagner entre 1980 et 1995, signifiant que la chasse intensive n'était pas le seul facteur contribuant au déclin de cette espèce. Dans les années 1980, les polluants organiques persistants (POPs), en particulier le DDT et les biphényles polychlorés (BPCs), furent rapidement soupçonnés après avoir été découvert en quantités énormes dans les carcasses des bélugas, surtout chez les juvéniles[5] - [21]. De nombreuses études[22] - [23] - [24] - [25] confirmèrent la relation entre le déclin de la population et ces polluants par la suite. Malgré ces découvertes alarmantes, les POPs ne seront bannis qu'en mai 2004 à la suite de l'adoption de la convention de Stockholm sur les polluants organiques persistants[26].
En date de 2012, on estime le nombre d'individus à 889[27], ce qui est une légère augmentation en contraste aux analyses entre 1973-1995, dans lesquelles on mentionnait entre 300-700 individus[10]. Cependant, le taux de croissance normal pour une population de béluga en santé devrait se situer entre 2.5% et 4%[28], alors que les valeurs mentionnées précédemment constituent un taux de croissance de moins de 1%[29]. De plus, la démographie de la population actuelle n'est pas soutenable et risque de provoquer une chute de population encore plus importante dans les prochaines années[27] si aucune action n'est entreprise, puisque le taux de juvéniles est trop faible pour assurer un renouvellement de la population.
Entre les années 1940 et 1980, le nombre de bélugas du Saint-Laurent a drastiquement diminué, passant d'environ 8 000 individus[30] - [31] à moins de 1 000[17]. Malgré les efforts de conservation et le moratoire sur la pêche de cet animal adopté par le Gouvernement du Canada en 1979[14], le groupe de baleine blanche stagne aux alentours de 700-900 individus depuis[27]. L'objectif à long terme, visant un rétablissement d'au moins 70 % de la quantité de bélugas pré-pêcheries[32], demeure bien loin d'être atteint. Les causes expliquant le déclin si important sont nombreuses.
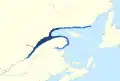 Aire de répartition : actuelle (2010) / étendue historique (1930)
Aire de répartition : actuelle (2010) / étendue historique (1930) Aire de répartition principale actuelle (2010) / étendue historique (1930)
Aire de répartition principale actuelle (2010) / étendue historique (1930)
Polluants organiques persistants
La présence de polluants organiques persistants (POPs) en quantités anormalement élevées dans les tissus adipeux des bélugas habitant dans l'estuaire du Saint-Laurent est sans doute l'une des causes les plus importantes du déclin[5] - [33]. Leurs niveaux de mercure, biphnényles polychlorés (BPCs) et DDT, tous considérés POPs, ont tous été établis à largement supérieurs à ceux que l'on retrouve dans les tissus des autres bélugas vivant dans l'océan Arctique[24] - [34].
Les POPs, avant leur interdiction d'utilisation en 2004, se sont accumulés dans l'environnement à la suite ded la combustion de certains composés nécessaires à la synthèse de produits chimiques, à l'utilisation de produits chimiques considérés POPs dans l'industrie agroalimentaire (par exemple, le DDT, un pesticide efficace mais néfaste pour l'environnement) et à la suite de leur synthèse dans la production industrielle en tant que sous-produit [35] - [25]. Ils appartiennent à la catégorie de molécules hydrophobes et lipophiles. Or, une molécule hydrophobe lipophile en milieu marin se stockera préférentiellement dans le corps des organismes, plus spécifiquement dans leurs tissus adipeux, ce qui explique leur accumulation dans le corps des mammifères marins[35]. De plus, le métabolisme des bélugas est très lent, ce qui signifie que le taux d'élimination métabolique des substances nocives comme les POPs s'en retrouve également réduit, ce qui les prédispose à accumuler de plus en plus de substances toxiques dans leurs tissus. Couplé au fait que les bélugas sont au sommet d'un réseau trophique où les proies absorbent également des POPs, il est facile pour eux d'accumuler rapidement des niveaux de POPs hautement toxiques dans leurs tissus[36].
Tel qu'attendu, les carcasses de bélugas qui ont été examinées démontraient une valeur atypiquement élevée de POPs relié aux zones industrialisées et fortement peuplées du bord du Fleuve Saint-Laurents[37]. Largement documentés comme des composés chimiques toxiques ayant des conséquences néfastes sur les organismes, les POPs pourraient affecter la longévité et la survie des bélugas de plusieurs façons.
Effets sur le système reproductif
Les polluants environnementaux en général possèdent souvent des effets néfastes sur la capacité à se reproduire[38]. Chez les animaux marins, la corrélation entre une eau chargée de polluants et la défaillance reproductive a été établie entre autres chez les phoques qui souffraient de sténose utérine lorsque la concentration de BPCs dans l'eau dépassait un certain seuil[39] - [40]. Les POPs sont aussi connus pour causer, chez les organismes marins, des naissances prématurées[41], un niveau de testostérone hors normes[42] et une progéniture moins nombreuse en raison du dysfonctionnement de l'appareil reproducteur des femelles[43]. Dans l'optique du béluga du Saint-Laurent, de telles répercussions sont soupçonnées puisque la démographie de la population est anormale (peu de juvéniles et peu de femelles gravides) et qu'il n'y a pas eu de croissance importante en termes du nombre d'individus depuis plusieurs dizaines d'années[27] - [10]. L'observation de l'utérus des carcasses des femelles bélugas laissent croire que l'activité ovarienne est moindre chez les bélugas du Saint-Laurent que ceux dans l'océan Arctique[44].
Effets verticaux
Les bélugas femelles possèdent en moyenne la plus faible concentration de POPs, et les juvéniles, la plus élevée, ce qui sous-entend un transfert vertical de polluants de la mère à sa progéniture par l'entremise du lait maternel[45] - [27]. Les juvéniles représentent le groupe d'âge avec le plus faible taux de survie puisque leur sensibilité aux polluants est accrue comparé aux adultes.
Tumeurs
La prévalence des tumeurs au sein de cette population est énorme: sur 21 carcasses recensées entre 1988 et 1990, 12 d'entre elles exprimaient une ou plusieurs tumeurs[46]. Certaines étaient inoffensives alors que d'autres non, contribuant probablement à la mort prématurée de l'individu en question. Les tumeurs ne sont pas courantes chez les animaux marins: parmi la famille des cétacés, seulement 75 cas ont été répertoriés jusqu'à présent et 28 de ces 75 cas (37%) proviennent de la population de bélugas du Saint-Laurent[46]. Certains POPs comme les BPCs, retrouvés en grande quantité dans le fleuve[47], sont reconnus comme inducteurs de tumeurs[48]. D'autres contaminants, tel le benzo[a]pyrène, un agent mutagène et cancérogène appartenant à la famille des hydrocarbures aromatiques polycycliques (HAPs), agissent en tant qu'initiateur dans les cellules, c'est-à-dire qu'il les prédisposent à devenir cancéreuses[48].
Baisse de l'efficacité du système immunitaire
Certains POPs, notamment les BPCs, ont un pouvoir immunosuppresseur puissant[49]. Ils peuvent induire une atrophie thymique[50] (un organe critique dans la fabrication de cellules immunitaires T), réduire l'efficacité du système immunitaire[51], diminuer la production d'anticorps[52] et sont associés à une baisse de lymphocytes dans le système lymphatique[53]. Tous ces facteurs diminuent la capacité de l'organisme à résister naturellement aux pathogènes: le risque d'infection virale est donc grandement augmenté. Une expérience menée sur les phoques où un groupe était nourrit avec des poissons contaminés aux POPs et l'autre était nourrit avec des poissons en santé a démontré une suppression immunitaire chez le groupe ingérant la variété contaminée[54]. Ces résultats suggèrent que l'immunosuppression apparente chez le béluga provient de la bioaccumulation de POPs dans leur système. Ceci expliquerait la fréquence élevée d'infections reliées à des pathogènes moyennement virulents retrouvée chez les bélugas du Saint-Laurent. Notamment, le virus Herpes simplex[55] a été retrouvé ainsi qu'un virus provoquant une infection ressemblant à la dermatite[56].
Dysfonctionnement de la glande thyroïde
La glande thyroïde est la glande principale régulant les système hormonaux. Le dérèglement de celle-ci causé par une présence anormalement élevée de BPCs dans l'environnement entraîne des niveaux exceptionnellement bas d'hormones dans l'organisme (dépression de la glande et donc baisse de production d'hormones lorsqu'exposé aux BPCs à long terme)[57] ainsi que des changements morphologiques de cette glande (apparition de micro-lésions qui pourraient compromettre son fonctionnement)[58]. Des lésions atypiques de la glande thyroïde ont été rapportées chez la faune résidant au sein du fleuve Saint-Laurent, indiquant une contamination importante aux BPCs[59]. Cependant, il est difficile de confirmer ou d'infirmer l'impact des BPCs sur l'expression de la glande thyroïde chez les bélugas en particulier, puisqu'il existe de la variation saisonnière au niveau de la morphologie de cette glande chez cette espèce[60].
Dysfonctionnement de la glande surrénale
Des excroissances anormales de la glande surrénale ont été répertoriées chez les organismes marins exposés à de hautes quantités de POPs, notamment chez les phoques vivant dans un environnement contaminé aux BPCs[61]. Des 24 carcasses de béluga examinées entre 1988 et 1900, cinq d'entre elles exprimaient des nodules (excroissances) sur cette glandes et sept d'entre elles, des kystes[62]. Une incidence aussi élevée de tels problèmes est anormale, considérant que ce genre de lésions n'a jamais été retrouvée chez les animaux domestiques[63]. Le développement de telles structures serait associé à de hauts niveaux de DDT environnant et altérerait le fonctionnement normal de la glande[59].
Impacts du transport maritime
Le fleuve Saint-Laurent est un attrait touristique populaire et une voie navigable régulièrement empruntée par les navires commerciaux. Chaque année, des milliers d'excursions pour l'observation de baleines sont organisées afin de pallier la demande touristique, en plus des 7 000 passages annuels des navires commerciaux de grande envergure[64]. Bien que le problème de collisions entre les bateaux et les bélugas est évident et bien répertorié, les impacts négatifs que ces activités ne se limitent pas à la mortalité directe[65]. Un trafic maritime important est associé à de hauts niveaux de stress chez le bélugas, qui peut se manifester de plusieurs façons: une réduction de fréquence d'allaitement des juvéniles[66], une dissociation du groupe familial[67], des retours à la surface moins fréquents[68], un évitement des endroits propices à contenir une quantité importante de proies s'il y a présence de bateaux[68] et un dispersement du groupe anormalement rapide[69]. Plus les navires sont nombreux, plus ces réactions sont observées et donc plus le niveau de stress associé est élevé[70].
Depuis 2013, le Marine Mammal Working Group[71], fondé spécialement pour cette recherche, a érigé une carte visant à réduire la vitesse et l'achalandage des navires dans certaines zones sensibles et critiques pour le béluga du Saint-Laurent et autres mammifères marins[72]. Comme il a été déterminé que le nombre de collisions entre les bateaux et les baleines augmente en fonction de la vitesse de croisière du bateau[73], la carte indique les zones à naviguer avec prudence, les zones où la réduction de vitesse est importante et les zones à éviter. Dans la zone de prudence, aucune réduction de vitesse n'est indiquée puisque ces endroits ne sont pas la zone primordiale pour les mammifères marins, mais ils peuvent y être présent; la navigation avec prudence y est donc conseillée[74]. Les zones où la réduction de vitesse à 10 nœuds ou moins est recommandée sont des zones ayant été répertoriées comme une aire importante d'alimentation pour les baleines[74]. Finalement, les zones à éviter représentent les endroits fréquentés par les baleines bleues, une espèce considérée menacée par la liste rouge de l'UICN[74]. Quatre ans après l'implantation de ces mesures, la prévalence des collisions entre navires et mammifères marins avait diminué de 40 % entre les mois de mai et octobre (les mois les plus achalandés en termes de trafic maritime), prouvant l'efficacité de ce nouveau programme[75] - [76].
Cependant, les mortalités directes et les dérangements ne sont pas les seuls maux causés par le passage des embarcations. Différentes études rapportent des réactions anormales de mammifères marins provoquées par l'étouffement de leur communication et orientation par écholocalisation, entrainé par le bruit des provenant de navires. Plusieurs comportements résultant de ce manque de communication auraient des répercussions sur l'organisme et pourraient mettre en péril sa survie. Par exemple, le bruit incessant des embarcations occasionnerait des altérations au niveau des échanges vocaux entre les individus, ce qui pourrait nuire à leur capacité à trouver de la nourriture et socialiser[77], ou encore provoquerait une surdité prématurée[78]. Grâce à la carte établie par le Marine Mammal Working Group interdisant le passage de bateaux dans les aires importantes pour les baleines, l'exposition au bruit serait diminuée en termes de volume, mais pas en termes de temps d'exposition au bruit, puisque les navires sont permis mais ralentis dans certains endroits moins critiques pour les mammifères marins [65]. Le passage plus lent de ces navires augmente le temps d'exposition des bélugas aux perturbations sonores. Les effets du temps d'exposition versus l'amplitude d'exposition restent à être déterminés.
Perspectives
La concentration de polluants organiques persistants dans le corps des bélugas et autres organismes faisant partie de l'écosystème de l'estuaire du Fleuve Saint-Laurent est projetée à la baisse pour les prochaines années[79], suivant le taux de dégradation naturel de ce polluant dans l'environnement. Néanmoins, la situation demeure précaire puisque ces produits toxiques sont encore présents en quantité suffisante pour diminuer l'aptitude (fitness) de la population des bélugas du Saint-Laurent, ce qui pourrait amener une spirale d'extinction[80]. Afin de s'assurer d'atteindre l'objectif visé, c'est-à-dire le rétablissement de la population vers des valeurs pré-chasse (8000 baleines blanches), un suivi régulier est nécessaire, même si les perspectives sont prometteuses en considérant l'impact diminué du transport maritime et la diminution des POPs.
En date d'octobre 2018, le Cosepac a établi un programme de rétablissement pour les bélugas vivant dans l'estuaire du Saint-Laurent[81] qui énonce six différents objectifs en vue d'assurer la restauration de la population : « 1) réduire les contaminants, chez le béluga, ses proies et leurs habitats ; 2) réduire le dérangement anthropique ; 3) assurer au béluga des ressources alimentaires accessibles et adéquates; 4) atténuer les effets des autres menaces sur le rétablissement de cette population; 5) protéger l’habitat du béluga sur toute son aire de répartition et 6) assurer un suivi régulier de la population de bélugas de l’estuaire du Saint-Laurent.»[82]. Le Cosepac espère rétablir cette population fragile dans un avenir rapproché en suivant ces lignes directrices.
 Printemps
Printemps Été
Été Automne
Automne Hiver
Hiver
Notes et références
- V. Lesage et Canadian Wildlife Service., Beluga Whale (Delphinapterus leucas) : St. Lawrence Estuary population, Environment Canada, (ISBN 9781100232843 et 1100232842, OCLC 945112657, lire en ligne)
- Daniel Martineau, Karin Lemberger, André Dallaire et Philippe Labelle, « Cancer in Wildlife, a Case Study: Beluga from the St. Lawrence Estuary, Québec, Canada », Environmental Health Perspectives, vol. 110, no 3, , p. 285–292 (ISSN 0091-6765, PMID 11882480, PMCID PMC1240769, DOI 10.1289/ehp.02110285, lire en ligne, consulté le )
- V. Lesage et MCS. Kingsley, « Updated status of the St Lawrence river population of the Beluga, Delphinapterus leucas », Can Field Nat, vol. 112, , p. 98-113 (ISSN 0008-3550)
- Pierre Béland, Sylvain DeGuise, Christiane Girard et André Lagacé, « Toxic Compounds and Health and Reproductive Effects in St. Lawrence Beluga Whales », Journal of Great Lakes Research, vol. 19, no 4, , p. 766–775 (ISSN 0380-1330, DOI 10.1016/s0380-1330(93)71264-2, lire en ligne, consulté le )
- (en) D. Martineau, P. Béland, C. Desjardins et A. Lagacé, « Levels of organochlorine chemicals in tissues of beluga whales (Delphinapterus leucas) from the St. Lawrence Estuary, Québec, Canada », Archives of Environmental Contamination and Toxicology, vol. 16, no 2, , p. 137–147 (ISSN 0090-4341 et 1432-0703, DOI 10.1007/bf01055795, lire en ligne, consulté le )
- (en) Véronique Lesage, Cyrille Barrette, Michael C. S. Kingsley et Becky Sjare, « The effect of vessel noise on the vocal behavior of Belugas in the St. Lawrence river estuary, Canada », Marine Mammal Science, vol. 15, no 1, , p. 65–84 (ISSN 0824-0469 et 1748-7692, DOI 10.1111/j.1748-7692.1999.tb00782.x, lire en ligne, consulté le )
- Saint-Cyr, DN, Report of a voyage to the Canadian Labrador: The pinniped mammals of the river and Gulf of St. Lawrence., vol. 37, Québec, Quebec Legislative Assembly Sessional Papers, , p. 42-55
- Charlevoix, Pierre-François-Xavier de, 1682-1761., Histoire et description générale de la Nouvelle France avec le journal historique d'un voyage fait par ordre du roi dans l'Amérique septentrionnale, Chez la veuve Ganeau, libraire, (ISBN 0665351496 et 9780665351495, OCLC 77470553, lire en ligne)
- Reeves RR et Mitchell Ed, « Catch history and initial population of white whales(Delphinapterus leucas) in the river and Gulf of St. Lawrence, eastern Canada », Naturaliste canadien (Revue ecologique et Systimatique), vol. 31, , p. 583-586
- (en) Michael C. S. Kingsley, « Population indew estimates for the St Lawrence belugas, 1973–1995 », Marine Mammal Science, vol. 14, no 3, , p. 508–529 (ISSN 0824-0469 et 1748-7692, DOI 10.1111/j.1748-7692.1998.tb00739.x, lire en ligne, consulté le )
- Beluga protection regulations under the Fisheries Act, PC 1980-2939, Canada Gazette II, 114 (21), p. 3445 SDR/80-835, 12 November
- L. Pippard, H. Malcolm, White Whales (Delphinapterus Leucas): Observations on Their Distribution, Population and Critical Habitats in the St. Lawrence and Saguenay Rivers, Department of Indian and Northern Affairs, Parks Canada, 1978
- J. Laurin, La chasse au béluga, Delphinapterus leucas, du Saint-Laurent et le statut actuel de la population, Carnet de zoologie (Société de zoologie de Québec), no 42, 1982, p. 23-27.
- R. R. Campbell, Rare and endangered fishes and marine mammals of Canada: Cosewic Fish and Marine Mammal Subcommittee status reports 11, Canadian Field-Naturalist no 99, 1985, p. 404-408.
- L. Pippard, Status of the St. Lawrence River population of Beluga, Delphinapterus leucas, Canadian field-naturalist. Ottawa ON, 99(3), 1985, p. 438-450.
- D.E. Sergeant et W. Hoek, « An update of the status of white whales Delphinapterus leucas in the Saint Lawrence estuary, Canada », Biological Conservation, vol. 45, no 4, , p. 287–302 (ISSN 0006-3207, DOI 10.1016/0006-3207(88)90060-2, lire en ligne, consulté le )
- P. Béland, R. Michaud, D. Martineau, Recensements de la population de bélugas Delphinapterus leucas du Saint-Laurent par embarcations en 1985? Ministère des pêches et des océans, Direction de la recherche sur les pêches? 1986
- M.C.S. Kingsley, M.O. Hammill, Photographic census surveys of the St. Lawrence beluga population, 1988 and 1990, Canadian Technical Report on Fisheries and Aquatic Sciences 1776, 1991, 19 pp.
- M. C. Kingsley, Census, trend and status of the St. Lawrence beluga population in 1992, 1993, p. 17, iological Sciences Branch, Québec Region, Department of Fisheries and Oceans, Maurice Lamontagne Institute.
- M. C. Kingsley, Population index estimate for the belugas of the St Lawrence in 1995, 1996, p. 38, Fish and Marine Mammals Division, Department of Fisheries and Oceans, Maurice Lamontagne Institute.
- D.E. Sergeant, Levels of Mercury and Organochlorine Residues in Tissues of Sea Mammals from the St Lawrence Estuary, Int. Council Explor. Sea, Marine Env. Quality Committee, CM 1980/E55, 1980
- R. Massé, D. Martineau, L. Tremblay, P. Béland, Concentrations and chromatographic profile of DDT metabolites and polychlorobiphenyl (PCB) residues in stranded beluga whales (Delphinapterus leucas) from the St. Lawrence Estuary, Canada, Archives of environmental contamination and toxicology, 15(5), 1986, p. 567-579.
- D.C.G. Muir, C. A. Ford, B. Rosenberg, R. J. Norstrom, M. Simon, P. Beland, Persistent organochlorines in beluga whales (Delphinapterus leucas) from the St Lawrence River estuary-I. Concentrations and patterns of specific PCBs, chlorinated pesticides and polychlorinated dibenzo-p-dioxins and dibenzofurans, Environmental Pollution, 93(2), 1996, p. 219-234.
- D.C.G. Muir, Organochlorine contaminants in belugas, Delphinapterus leucas, from Canadian waters, Can. Bull. Fish Aquat. Sci., 224, 1990, p. 165-190.
- (en) Michel Lebeuf, Bruno Gouteux, Lena Measures et Steve Trottier, « Levels and Temporal Trends (1988−1999) of Polybrominated Diphenyl Ethers in Beluga Whales (Delphinapterus leucas) from the St. Lawrence Estuary, Canada », Environmental Science & Technology, vol. 38, no 11, , p. 2971–2977 (ISSN 0013-936X et 1520-5851, DOI 10.1021/es035187j, lire en ligne, consulté le )
- United Nations Environment Programme, The Stockholm Convention on Persistent Organic Pollutants (UNEP, Nairobi, 2001)
- A. Mosnier, T. Doniol-Valcroze, J.-F. Gosselin et V. Lesage, « Insights into processes of population decline using an integrated population model: The case of the St. Lawrence Estuary beluga (Delphinapterus leucas) », Ecological Modelling, vol. 314, , p. 15–31 (ISSN 0304-3800, DOI 10.1016/j.ecolmodel.2015.07.006, lire en ligne, consulté le )
- Department of Fisheries and Oceans. Recovery Assessment Report on Cumberland Sound, Ungava Bay, Eastern Hudson Bay, and St Lawrence Beluga Populations (Delphinapterus leucas). Ottawa, Canada: Fisheries and Oceans Canada, 2005.
- Department of Fisheries and Oceans. Recovery Strategy for the Beluga Whale (Delphinapterus leucas) St Lawrence Estuary Population in Canada: Species at Risk Act Recovery Strategy Series. Ottawa, Canada: Fisheries and Oceans Canada, 2012.
- MO. Hammill, LN. Measures, J-F. Gosselin et al, Lack of Recovery in St Lawrence Estuary Beluga, Ottawa, Canada: Fisheries and Oceans Canada, 2007.
- R.R. Reeves, E. Mitchell, Catch history and initial population of white whales (Delphinapterus leucas) in the river and Gulf of St. Lawrence, eastern Canada, Naturaliste canadien, 111(1), 1984, p. 63-121.
- Department of Fisheries and Oceans. Recovery Strategy for the Beluga Whale (Delphinapterus leucas) St Lawrence Estuary Population in Canada: Species at Risk Act Recovery Strategy Series. Ottawa, Canada: Fisheries and Oceans Canada, 2012
- D. Martineau, A. Lagace, P. Beland, R. Higgins, D. Armstrong, LR. Shugart, Pathology of stranded beluga whales (Delphinapterus leucas) from the St. Lawrence estuary, Quebec, Canada, J Comp Pathol no 98, 1988, p. 287-311
- R. R. E. A. Wagemann, R. E. A. Stewart, P. Beland, C. Desjardins, Heavy metals and selenium in tissues of beluga whales, Delphinapterus leucas, from the Canadian Arctic and the St. Lawrence estuary, Canadian bulletin of fisheries and aquatic sciences/Bulletin canadien des sciences halieutiques et aquatiques, 1990.
- K.C. Jones et P. de Voogt, « Persistent organic pollutants (POPs): state of the science », Environmental Pollution, vol. 100, nos 1-3, , p. 209–221 (ISSN 0269-7491, DOI 10.1016/s0269-7491(99)00098-6, lire en ligne, consulté le )
- (en) Paul D. Jepson et Robin J. Law, « Persistent pollutants, persistent threats », Science, vol. 352, no 6292, , p. 1388–1389 (ISSN 0036-8075 et 1095-9203, PMID 27313021, DOI 10.1126/science.aaf9075, lire en ligne, consulté le )
- (en) S. Lair, L. N. Measures et D. Martineau, « Pathologic Findings and Trends in Mortality in the Beluga (Delphinapterus leucas) Population of the St Lawrence Estuary, Quebec, Canada, From 1983 to 2012 », Veterinary Pathology, vol. 53, no 1, , p. 22–36 (ISSN 0300-9858 et 1544-2217, DOI 10.1177/0300985815604726, lire en ligne, consulté le )
- Theo Colborn, Frederick S. vom Saal et Ana M. Soto, « Developmental effects of endocrine-disrupting chemicals in wildlife and humans », Environmental Impact Assessment Review, vol. 14, nos 5-6, , p. 469–489 (ISSN 0195-9255, DOI 10.1016/0195-9255(94)90014-0, lire en ligne, consulté le )
- J. R. Baker, Pollution-associated uterine lesions in grey seals from the Liverpool Bay area of the Irish Sea, Veterinary Record, 125(11), 1989, p. 303.
- E. Helle, M. Olsson, S. Jensen, PCB levels correlated with pathological changes in seal uteri, Ambio, 1976, p. 261-262.
- (en) Robert L. DeLong, William G. Gilmartin et John G. Simpson, « Premature Births in California Sea Lions: Association with High Organochlorine Pollutant Residue Levels », Science, vol. 181, no 4105, , p. 1168–1170 (ISSN 0036-8075 et 1095-9203, PMID 4199282, DOI 10.1126/science.181.4105.1168, lire en ligne, consulté le )
- An Subramanian, S Tanabe, R Tatsukawa et S Saito, « Reduction in the testosterone levels by PCBs and DDE in Dall's porpoises of northwestern North Pacific », Marine Pollution Bulletin, vol. 18, no 12, , p. 643–646 (ISSN 0025-326X, DOI 10.1016/0025-326x(87)90397-3, lire en ligne, consulté le )
- P. J. Reijnders, Reproductive failure in common seals feeding on fish from polluted coastal waters, Nature, 324(6096), 1986, p. 456-457.
- S. De Guise, P. Beland, Étude histologique de coupes sériées d'ovaires de bélugas (Delphinapterus leucas) du Saint-Laurent, Mont-Joli:Fisheries and Oceans Canada, 1994.
- (en) Robert Massé, Daniel Martineau, Lyne Tremblay et Pierre Béland, « Concentrations and chromatographic profile of DDT metabolites and polychlorobiphenyl (PCB) residues in stranded beluga whales (Delphinapterus leucas) from the St. Lawrence Estuary, Canada », Archives of Environmental Contamination and Toxicology, vol. 15, no 5, , p. 567–579 (ISSN 0090-4341 et 1432-0703, DOI 10.1007/bf01056571, lire en ligne, consulté le )
- (en) S. De Guise, A. Lagacé et P. Béland, « Tumors in St. Lawrence Beluga Whales (Delphinapterus leucas) », Veterinary Pathology, vol. 31, no 4, , p. 444–449 (ISSN 0300-9858 et 1544-2217, DOI 10.1177/030098589403100406, lire en ligne, consulté le )
- JP. Trdpanier, Biphényles polychlorés: informations générales et situation au Québec, Min Environ Québec Canada, Service d'analyse et des Études d'impact, 1984, 192 p.
- (en) Wayne Levin, Alexander Wood, Richard Chang et Dene Ryan, « Oxidative Metabolism of Polycyclic Aromatic Hydrocarbons to Ultimate Carcinogens », Drug Metabolism Reviews, vol. 13, no 4, , p. 555–580 (ISSN 0360-2532 et 1097-9883, DOI 10.3109/03602538209011087, lire en ligne, consulté le )
- R. D. Kimbrough, A. A. Jensen, (Eds.), Halogenated biphenyls, terphenyls, naphthalenes, dibenzodioxins and related products, vol. 4, Elsevier, 2012, p. 295-322.
- L Andersson, « Effects of polychlorinated biphenyls with Ah receptor affinity on lymphoid development in the thymus and the bursa of Fabricius of chick embryos in Ovo and in mouse thymus anlagen in vitro », Toxicology and Applied Pharmacology, vol. 107, no 1, , p. 183–188 (ISSN 0041-008X, DOI 10.1016/0041-008x(91)90342-c, lire en ligne, consulté le )
- Ralph J. Smialowicz, James E. Andrews, Marie M. Riddle et Ronald R. Rogers, « Evaluation of the immunotoxicity of low level PCB exposure in the rat », Toxicology, vol. 56, no 2, , p. 197–211 (ISSN 0300-483X, DOI 10.1016/0300-483x(89)90133-9, lire en ligne, consulté le )
- H. Tryphonas, S. Hayward, L. O'Grady et J.C.K. Loo, « Immunotoxicity studies of PCB (Aroclor 1254) in the adult rhesus (Macaca Mulatta) monkey — preliminary report », International Journal of Immunopharmacology, vol. 11, no 2, , p. 199–206 (ISSN 0192-0561, DOI 10.1016/0192-0561(89)90072-6, lire en ligne, consulté le )
- (en) Ih Chu, David Villeneuve, Viateur Secours et Victor Valli, « Toxicological assessment of chlorinated diphenyl ethers in the rat », Journal of Environmental Science and Health, Part B, vol. 24, no 5, , p. 493–508 (ISSN 0360-1234, DOI 10.1080/03601238909372663, lire en ligne, consulté le )
- R.L. de Swart, P.S. Ross, E.J. Vedder, H.H. Timmerman, S. Heisterkamp, H. van Loveren, A.D.M.E. Osterhaus, Impairment of Immune Function in Harbor Seals (Phoca vitulina) Feeding on Fish from Polluted Waters, Ambio, 23(2), 1994, p. 155–159 (doi:10.1579/0044-7447-31.1.1)
- (en) Bradd Barr, J. Lawrence Dunn, M. D. Daniel et Amy Banford, « Herpes-like Viral Dermatitis in a Beluga Whale (Delphinapterus leucas) », Journal of Wildlife Diseases, vol. 25, no 4, , p. 608–611 (ISSN 0090-3558, DOI 10.7589/0090-3558-25.4.608, lire en ligne, consulté le )
- (en) I. Mikaelian, J.-M. Lapointe, P. Labelle et R. Higgins, « Dermatophilus-like infection in beluga whales, Delphinapterus leucas, from the St. Lawrence estuary », Veterinary Dermatology, vol. 12, no 1, , p. 59–62 (ISSN 0959-4493 et 1365-3164, DOI 10.1046/j.1365-3164.2001.00216.x, lire en ligne, consulté le )
- (en) James J. Byrne, John P. Carbone et Ellen A. Hanson, « Hypothyroidism and Abnormalities in the Kinetics of Thyroid Hormone Metabolism in Rats Treated Chronically with Polychlorinated Biphenyl and Polybrominated Biphenyl* », Endocrinology, vol. 121, no 2, , p. 520–527 (ISSN 0013-7227 et 1945-7170, DOI 10.1210/endo-121-2-520, lire en ligne, consulté le )
- (en) W. T. Collins Jr, C. C. Capen, L. Kasza, C. Carter, R. E. Dailey, Effect of polychlorinated biphenyl (PCB) on the thyroid gland of rats: ultrastructural and biochemical investigations, The American Journal of Pathology, 89(1), 1977, p. 119.
- (en) S. De Guise, D. Martineau, P. Béland, M. Fournier, Possible mechanisms of action of environmental contaminants on St. Lawrence beluga whales (Delphinapterus leucas), Environmental Health Perspectives, 103 (suppl. 4), 1995, p. 73.
- (en) D. J. St. Aubin et J. R. Geraci, « Seasonal variation in thyroid morphology and secretion in the white whale, Delphinapterus leucas », Canadian Journal of Zoology, vol. 67, no 2, , p. 263–267 (ISSN 0008-4301 et 1480-3283, DOI 10.1139/z89-038, lire en ligne, consulté le )
- A. Bergman, M. Olsson, Pathology of Baltic grey seal (Halichoerus gryphus) and ringed seal (Pusa hispida) females with special reference to adreno-cortical hyperplasia: is environmental pollution the cause of a widely distributed disease syndrome, In Proceedings of the Symposium on Seals in the Baltic and Eurasian Lakes, juin 1985, p. 5-8.
- S. De Guise, A. Lagacé, P. Béland et C. Girard, « Non-neoplastic lesions in beluga whales (Delphinapterus leucas) and other marine mammals from the St lawrence estuary », Journal of Comparative Pathology, vol. 112, no 3, , p. 257–271 (ISSN 0021-9975, DOI 10.1016/s0021-9975(05)80079-9, lire en ligne, consulté le )
- C. C. Capen, The endocrine glands, In: Pathology of Domestic Animals, vol. 3, 4e ed., K. V. F. Jubb, P. C. Kennedy et N. Palmer, Eds, Academic Press, New York, 1985, p. 267, 348.
- C. Chion, S. Turgeon, R. Michaud, J. A. Landry, L. Parrott, Portrait de la navigation dans le parc marin du Saguenay–Saint-Laurent, Caractérisation des activités sans prélèvement de ressources entre le 1er mai et le 31, 2007.
- Clément Chion, Dominic Lagrois, Jérôme Dupras et Samuel Turgeon, « Underwater acoustic impacts of shipping management measures: Results from a social-ecological model of boat and whale movements in the St. Lawrence River Estuary (Canada) », Ecological Modelling, vol. 354, , p. 72–87 (ISSN 0304-3800, DOI 10.1016/j.ecolmodel.2017.03.014, lire en ligne, consulté le )
- Canada Department of Fisheries and Oceans (1987). Statement of the Problems of the St. Lawrence Belugas: Report of the Ad Hoc Committee for the Conservation of the St. Lawrence Belugas. Canada Department of Fisheries and Oceans, Ottawa, Ontario, Canada: 27 pp.
- K. J. Finley, R. A. Davis, Reactions of Beluga Whales and Narwhals to Ship Traffic and Ice-Breaking along Ice Edges in the Eastern Canadian High Arctic, 1982-1984: An Overview. Environmental Studies no 37, Ottawa, Ont., Canada: Canadian Dept. of Indian Affairs and Northern Development, Northern Environmental Protection Branch, Northern Affairs Program, 1984.
- P. G. Evans, The natural history of whales & dolphins, Facts on File, 1987.
- W. John Richardson, Mark A. Fraker, Bernd Würsig et Randall S. Wells, « Behaviour of Bowhead Whales Balaena mysticetus summering in the Beaufort Sea: Reactions to industrial activities », Biological Conservation, vol. 32, no 3, , p. 195–230 (ISSN 0006-3207, DOI 10.1016/0006-3207(85)90111-9, lire en ligne, consulté le )
- (en) Jean M. Blane et Reiner Jaakson, « The Impact of Ecotourism Boats on the St Lawrence Beluga Whales », Environmental Conservation, vol. 21, no 3, 1994/ed, p. 267–269 (ISSN 1469-4387 et 0376-8929, DOI 10.1017/S0376892900033282, lire en ligne, consulté le )
- Marine Mammal Working Group
- C. C. Guard, M. Aids, Notices to Mariners Publication. Eastern Edition [electronic Resource], Canadian Coast Guard, 2004.
- David W. Laist, Amy R. Knowlton, James G. Mead et Anne S. Collet, « Collisions between ships and whales », Marine Mammal Science, vol. 17, no 1, , p. 35–75 (ISSN 0824-0469 et 1748-7692, DOI 10.1111/j.1748-7692.2001.tb00980.x, lire en ligne, consulté le )
- (en-CA) « Working Group on Marine Traffic and Protection of Marine Mammals | Whales online », Baleines en direct, (lire en ligne, consulté le )
- C. Chion, Impacts des mesures volontaires visant à réduire les risques de collisions mortelles de grands rorquals avec des navires marchands dans l’estuaire du Saint-Laurent en 2016, Mise à jour de l’évaluation des gains en conservation des mesures volontaires proposées par le Groupe de travail sur le transport maritime et la protection des mammifères marins (G2T3M) et l’évaluation de leur impact sur le temps de transit des navires marchands, présenté à Pêches et Océans Canada et Parcs Canada, Université du Québec en Outaouais, Gatineau, 2017
- (en) Clément Chion, Samuel Turgeon, Guy Cantin et Robert Michaud, « A voluntary conservation agreement reduces the risks of lethal collisions between ships and whales in the St. Lawrence Estuary (Québec, Canada): From co-construction to monitoring compliance and assessing effectiveness », PLOS ONE, vol. 13, no 9, , e0202560 (ISSN 1932-6203, PMID 30240393, PMCID PMC6150506, DOI 10.1371/journal.pone.0202560, lire en ligne, consulté le )
- (en) Veronique Lesage, Cyrille Barrette, Michael C. S. Kingsley et Becky Sjare, « The effect pf Vessel noise on the vocal behavior of belugas in the St. Lawrence river estuary, Canada », Marine Mammal Science, vol. 15, no 1, , p. 65–84 (ISSN 0824-0469 et 1748-7692, DOI 10.1111/j.1748-7692.1999.tb00782.x, lire en ligne, consulté le )
- (en) James J. Finneran, Carolyn E. Schlundt, Randall Dear et Donald A. Carder, « Temporary shift in masked hearing thresholds in odontocetes after exposure to single underwater impulses from a seismic watergun », The Journal of the Acoustical Society of America, vol. 111, no 6, , p. 2929–2940 (ISSN 0001-4966, DOI 10.1121/1.1479150, lire en ligne, consulté le )
- Brendan E Hickie, Michael CS Kingsley, Peter V Hodson et Derek CG Muir, « A modelling-based perspective on the past, present, and future polychlorinated biphenyl contamination of the St. Lawrence beluga whale (Delphinapterus leucas) population », Canadian Journal of Fisheries and Aquatic Sciences, vol. 57, no S1, , p. 101–112 (ISSN 0706-652X et 1205-7533, DOI 10.1139/f99-242, lire en ligne, consulté le )
- A Iqbal, L Measures, S Lair et B Dixon, « Toxoplasma gondii infection in stranded St. Lawrence Estuary beluga Delphinapterus leucas in Quebec, Canada », Diseases of Aquatic Organisms, vol. 130, no 3, , p. 165–175 (ISSN 0177-5103 et 1616-1580, DOI 10.3354/dao03262)
- [PDF] Programme de rétablissement pour les bélugas vivant dans l'estuaire du Saint-Laurent
- Demers, Andréanne. et Canada. Ministère des pêches et des océans., Programme de rétablissement du béluga (Delphinapterus leucas), population de l'estuaire du Saint-Laurent au Canada, Pêches et océans Canada, (ISBN 9781100985923 et 1100985921, OCLC 809971496, lire en ligne)