Acide aminolévulinique synthase
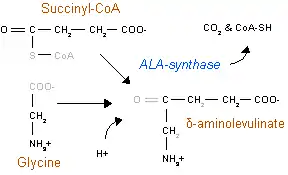
L'acide aminolévulinique synthase ou ALA synthase (ou encore ALAS) est une enzyme de type acyltransférase qui a été découverte pour la première fois chez la bactérie Rhodobacter sphaeroides et les érythrocytes de poulet dans les laboratoires de Shemin et Neuberger en 1958[1]. Cette enzyme catalyse la synthèse de l'acide aminolévulinique (ALA), le premier précurseur commun de la biosynthèse de tous les tétrapyrroles. L'ALA est synthétisé via la condensation de la glycine et de la succinyl-CoA. L'enzyme ALAS est présente chez tous les eukaryotes non-plantes et dans la classe α des protéobactéries. Les autres organismes produisent l'ALA via la voie de Shemin impliquant trois enzymes.
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | PLP |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Dans le corps humain, deux formes d'ALAS existent. La première, ALAS1, est exprimée dans tous les types cellulaires, tandis que la deuxième, ALAS2, n'est exprimée que dans les précurseurs des globules rouges. Les ARN messagers des deux formes présentent 60 % de similarité[2].
ALAS2
| Delta-aminolevulinate synthase 2 | ||
| Caractéristiques générales | ||
|---|---|---|
| Nom approuvé | 5'-aminolevulinate synthase 2 | |
| Symbole | ALAS2 | |
| Synonymes | ASB, ANH1, XLSA, ALASE, XLDPP, XLEPP, ALAS-E | |
| Locus | Xp11.21 | |
| Localisation | 55035488-55057497 | |
| Profils d'expression de l’ARN | ||
| Homme | ||
| Autre symbole | ASB, ANH1, XLSA, ALASE, XLDPP, XLEPP, ALAS-E | |
| Chromosome et locus | Xp11.21 | |
| N° EC | 2.3.1.37 | |
| Entrez | 212 | |
| HUGO | 397 | |
| OMIM | 301300 | |
| UniProt | P22557 | |
| RefSeq | NM_000032 | |
| Liens accessibles depuis GeneCards et HUGO. | ||
La Delta-aminolevulinate synthase 2, aussi abrégée en ALAS2, est une protéine qui, chez les humains, est encodée par le gène ALAS2. Cette protéine est une enzyme spécifique aux mitochondrie des cellules érythroïdes qui catalyse la première étape de la bio-synthèse de l'hème[1]. Son ARN messager contient un IRE dans la région 5'-UTR[2] sur lequel un IRP vient se fixer en situation de carence en fer, inhibant alors la traduction de l'ARNm.
Notes et références
- (en) G. C. Ferreira et J. Gong, « 5-Aminolevulinate synthase and the first step of heme biosynthesis », J. Bioenerg. Biomembr., vol. 27, no 2, , p. 151--159
- (en) T. C. Cox, M. J. Bawden et al., « Human erythroid 5-aminolevulinate synthase: promoter analysis and identification of an iron-responsive element in the mRNA », EMBO J., vol. 10, no 7, , p. 1891--1902