Viande artificielle
La viande artificielle est créée à partir d'une biotechnologie permettant de reproduire artificiellement des produits d’origine animale par la culture de microorganismes ou de cellules. Parmi ces produits, on distingue les produits « acellulaires » (lait, blanc d’œuf) des produits « cellulaires » (viandes, poissons et fruits de mer).
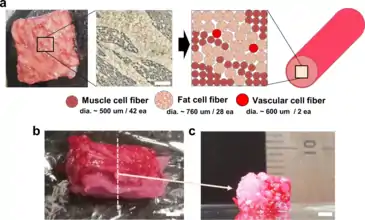
Différences avec la viande d'origine animale
La viande, telle qu’elle est définie par le Parlement européen, est un « muscle squelettique avec graisse et tissu conjonctif naturellement inclus ou adhérents ». C’est un alliage complexe de différents éléments, dont des muscles squelettiques, des tissus conjonctifs, des vaisseaux sanguins et des nerfs[1].
A l’inverse, la viande cellulaire reproduit principalement les myocytes, aussi appelées fibres musculaires, car ce sont les principaux constituants de la viande[2]. Elle se rapproche ainsi davantage d’un « tissu musculaire » que de viande à proprement parler, et le terme d’amas cellulaires semble plus approprié tant le résultat issu des laboratoires est éloigné de la viande[3]. La chercheuse Marie-Pierre Ellies explique quant à elle que « dans le milieu de la recherche, on a plutôt tendance à parler de fibres musculaires en culture »[4].
Une autre étape incontournable dans la constitution de la viande réside dans le processus de maturation. Après l’abattage de l’animal, les muscles se contractent, se rigidifient, et le glycogène est converti en lactate en raison de l’absence d’alimentation en oxygène par le sang. Cette production de lactate conduit à une baisse du pH. Diverses enzymes s’activent alors et coupent les protéines musculaires, ce qui a pour effet d’attendrir la viande et de lui donner une texture particulière[5].
Ce phénomène, pourtant analysé durant des décennies par les chercheurs en viande, reste cependant mal compris et donc négligé par l’agriculture cellulaire, notamment du fait de sa complexité et du manque de connaissance qui persistent pour les cellules cultivées. Cela explique, en partie, l’ajout de nombreux ingrédients tels que la chapelure, la poudre d'œuf, ou encore le jus de betterave, afin de masquer les défauts sensoriels de la viande artificielle[6].
Enfin, la production cellulaire n’est pas considérée comme de la viande d’un point de vue réglementaire car la « viande cultivée» rentre dans la catégorie des nouveaux aliments sur un plan réglementaire[7].
Techniques de production
Lignées cellulaires
Eva et al. expliquent que de telles « lignées cellulaires » peuvent être obtenues de deux manières différentes : par induction ou par sélection de mutations spontanées [8]. La première méthode consiste en la modification génétique ou chimique de cellules quand la seconde technique consiste à sélectionner des mutations spontanées. Dans les deux cas, l’innocuité n’est pas assurée puisqu’il s’agit de cultiver des cellules cancérigènes pouvant avoir des conséquences tumorigènes comme en témoigne un brevet de Memphis Meats [9] - [10].
Jean-François Hocquette, directeur de recherche à l'INRAE, s’inquiète tout particulièrement des conséquences possibles de l’ingestion de cellules cancéreuses, dans la mesure où elles risquent de ne pas être identifiées parmi toutes les autres cellules[6]. Il a d’ailleurs été démontré que l'ADN des cellules végétales génétiquement modifiées peut être transféré dans la microflore du tractus gastro-intestinal humain, ce qui pourrait aussi être le cas avec les lignées cellulaires. Ce risque fait ainsi dire à Nawaz et ali. qu’une « diligence raisonnable exigerait des recherches supplémentaires sur les cellules animales génétiquement modifiées »[11].
En outre, Soice et ali soulignent que « la confirmation de la sécurité des futurs produits fabriqués à partir de cellules animales immortalisées exprimant des oncogènes, que ce soit par immortalisation spontanée ou par génie génétique, représente une lacune dans les connaissances dans ce domaine » et qu‘ « aucune lignée cellulaire immortelle disponible dans le commerce et pertinente pour l'agriculture n'a été confirmée comme étant sûre pour les aliments. » [12]. La question de l’innocuité des cellules souches n'est pas résolue.
Par ailleurs, quand bien même les connaissances scientifiques permettraient d’affirmer que ces techniques sont sans risques, il faudrait encore surveiller les cellules pour éviter toute contamination et dérive génétique dans la mesure où la contamination des lignées cellulaires peut être courante en culture cellulaire[13].
La capacité des acteurs industriels de la viande artificielle à assurer la sanité de leurs produits est donc parfois remise en question.
Santé
Il semble aujourd'hui difficile de prévoir les effets, les risques et les dangers possibles qui découlent de cette nouvelle forme de production[14].
Des chercheurs pointent ainsi le fait que la littérature scientifique soit lacunaire et incomplète sur certains thèmes, et qu’elle omette de s’attarder sur certaines critiques. Le nombre d’études scientifiques recensées en 2020 s’élevait à seulement 300 contre plus de 12 000 articles de presse, ce qui représente un vivier très peu fourni[15].
Linsay Ketelings, chercheuse à l'université de Maastricht, abonde dans ce sens et souligne que « le manque de recherches approfondies liées à la caractérisation des dangers et des risques de la viande cultivée est considéré comme le plus grand obstacle à l'introduction d'un produit sûr sur le marché »[16].
La communauté scientifique reste donc globalement réservée, et ne s’est pas prononcée sur les nombreuses incertitudes qui planent encore. Une des raisons à ce manque d’études, est l’absence d’un processus de fabrication unique ainsi que l’immaturité des technologies actuelles[17].
De plus, il est légitime de douter de la capacité de l’agriculture cellulaire à se passer d’antibiotiques[18]. Pour appuyer leur argumentaire, les promoteurs de l’agriculture cellulaire soulignent que « les animaux d’élevage industriel consomment aujourd’hui environ la même quantité d’antibiotiques que les humains »[19]. Et, s’il est vrai que l’agriculture contribue principalement au développement de l’antibiorésistance, la présentation de cet argument est fallacieuse. Ils omettent en effet de préciser que, si certains pays comme les États-Unis encadrent assez peu l’utilisation d’antibiotiques, « les niveaux d'utilisation varient considérablement d'un pays à l'autre ; par exemple, certains pays d'Europe du Nord utilisent des quantités très faibles pour traiter les animaux. »[20].
Économie
De nombreux pays contribuent à l'économie de la viande cellulaire car guidés par des considérations de sécurité alimentaire. C’est notamment le cas de Singapour, qui importe 90% de ses biens alimentaires, tout comme pour Israël[21] - [22]. Singapour est ainsi le premier État à autoriser la mise sur le marché de nourriture cellulaire[23].
Paul Ariès, spécialiste de l’alimentation et de l’élevage paysan ayant publié plusieurs essais sur le sujet, résume ainsi l'enjeu économique de la viande artificielle : « Les champions de la viande sale d’aujourd’hui sont les champions de la fausse viande de demain »[24].
Droit
La France a d’ores et déjà interdit la « viande artificielle » des services de restauration scolaires, universitaires, des établissements de santé, des établissements sociaux et médico-sociaux et des établissements pénitentiaires[25].
Environnement
Les arguments mis en avant par les tenants de l’agriculture cellulaire sont, assez souvent des arguments « largement spéculatifs » sans réelle valeur scientifique et ne reposant que sur des données déclaratives[26]. Dans ces conditions, les limites techniques et technologiques que l’industrie rencontre pourraient conduire l’agriculture cellulaire à ne jamais tenir ses promesses. Affirmer que l’agriculture cellulaire serait bénéfique pour l’environnement, car moins polluante que l’agriculture d’élevage, est aujourd’hui remis en cause[27] - [28].
Reste également la question du sérum fœtal bovin (SFB). En effet, lors de la culture de cellules synthétiques bovines, un milieu de culture et un sérum sont nécessaires pour que les cellules prolifèrent et se différencient. La source du milieu et du sérum est considérée comme un défi car des résidus peuvent se retrouver dans le produit final. L’utilisation de ce sérum soulève des problèmes moraux et éthiques importants car le processus nécessite de prélever le sérum sur des vaches en gestation, ce qui a pour conséquence la mort des fœtus par suffocation[29].
Références
- « Rectificatif au règlement (CE) n° 853/2004 du Parlement européen et du Conseil du 29 avril 2004 fixant des règles spécifiques d’hygiène applicables aux denrées alimentaires d’origine animale (JO L 139 du 30.4.2004)’. »,
- Stephens, N., Di Silvio, L., Dunsford, I., Ellis, M., Glencross, A., & Sexton, A., « Bringing cultured meat to market : Technical, socio-political, and regulatory challenges in cellular agriculture »,
- INRAE Institutionnel, « La viande in vitro, une voie exploratoire controversée »
- Radio France, « Agriculture cellulaire, viande de synthèse : La nourriture de demain ? »
- G. Monin, Facteurs biologiques des qualités de la viande bovine, , pp.151-160.
- Hocquette, J.-F., « Is in vitro meat the solution for the future? »,
- Boler, D. D., & Woerner, D. R., « What is meat? A perspective from the american meat science association »,
- Ramboer, E., De Craene, B., De Kock, J., Vanhaecke, T., Berx, G., Rogiers, V., & Vinken, M., « Strategies for immortalization of primary hepatocytes. Journal of hepatology »,
- Wang, Y., Chen, S., Yan, Z., & Pei, M., « A prospect of cell immortalization combined with matrix microenvironmental optimization strategy for tissue engineering and regeneration »,
- Mosa, « Meat Compositions and methods for increasing the culture density of a cellular biomass within a cultivation infrastructure. »,
- Nawaz, M. et ali., « Addressing concerns over the fate of DNA derived from genetically modified food in the human body : A review. Food and Chemical Toxicology »,
- Soice, E., & Johnston, J., « Immortalizing cells for human consumption »,
- Geraghty, R. J et ali., « Guidelines for the use of cell lines in biomedical research. »,
- Bhat, Z. F., Morton, J. D., Mason, S. L., Bekhit, A. E. A., & Bhat, H. F., « Technological, regulatory, and ethical aspects of in vitro meat : A future slaughter‐free harvest. »,
- Chriki, S., Ellies-Oury, M.-P., Fournier, D., Liu, J., & Hocquette, J.-F., « Analysis of scientific and press articles related to cultured meat for a better understanding of its perception »,
- Ketelings, L., Kremers, S., & de Boer, A., « The barriers and drivers of a safe market introduction of cultured meat : A qualitative study »,
- Ketelings, L., Kremers, S., & de Boer, A., « The barriers and drivers of a safe market introduction of cultured meat : A qualitative study. »,
- Tomiyama, A. J., Kawecki, N. S., Rosenfeld, D. L., Jay, J. A., Rajagopal, D., & Rowat, A. C., « Bridging the gap between the science of cultured meat and public perceptions »,
- Agriculture Cellulaire France, « Les bénéfices de l’agriculture cellulaire »
- European Medicines Agency, « Sales of veterinary antimicrobial agents in 30 European countries in 2015 : Trends from 2010 to 2015 »,
- Trésor, D. générale du., « Commerce extérieur de Singapour : Bilan de l’année 2020 et du S1 2021 »
- Mancini, M. C., & Antonioli, F., « The future of cultured meat between sustainability expectations and socio-economic challenges »,
- Le Monde.fr., « Singapour autorise la vente de viande artificielle, une première mondiale. »
- Hadjadji, N., « Google prendra-t-il le contrôle de nos assiettes ? »
- « Amendement N°896 à la loi dite de Lutte contre le dérèglement climatique - (N° 3875) »
- Ipes food, « Report | the politics of protein »
- Santo, R. E., Kim, B. F., Goldman, S. E., Dutkiewicz, J., Biehl, E. M. B., Bloem, M. W., Neff, R. A., & Nachman, K. E., « Considering plant-based meat substitutes and cell-based meats : A public health and food systems perspective »,
- Rodríguez Escobar, M. I., Cadena, E., Nhu, T. T., Cooreman-Algoed, M., De Smet, S., & Dewulf, J., « Analysis of the cultured meat production system in function of its environmental footprint : Current status, gaps and recommendations »,
- « Vidéo L214 : vache gestante abattue, sang du foetus de veau prélevé... l'horreur filmée dans un abattoir Bigard », sur midilibre.fr (consulté le )