Vaccination et évolution de la virulence
Un pathogène est un organisme capable d’infecter un autre organisme appelé hôte. La virulence d’un pathogène est désignée comme étant la capacité de celui-ci à se multiplier à l’intérieur de l’organisme et d’y provoquer un état pathologique. La vaccination désigne un moyen de protection contre les agents pathogènes permettant de stimuler le système immunitaire d'un individu. À long terme, le vaccin semble être efficace dans une population, néanmoins il peut avoir un impact sur l'évolution de la virulence du pathogène[1].
Généralités
L’injection d’un vaccin va déclencher une réponse immunitaire dite « primaire », car l'antigène à la surface de la cellule pathogène va être reconnu par les récepteurs des cellules du système immunitaire : les lymphocytes. Grâce à cette reconnaissance, des lymphocytes mémoires vont être produits par l’organisme, ce qui permettra en cas d’une réelle infection, une réaction immunitaire secondaire beaucoup plus rapide et de plus forte amplitude.
Le vaccin peut être préventif, c’est-à-dire qu’un individu se fait vacciner sans être infecté ou thérapeutique, quand l'individu est déjà contaminé.
D’un point de vue historique, c’est au Ve siècle av. J.-C. que l’on décrit pour la première fois un phénomène d’immunité, lors d’une épidémie de peste à Athènes. Les personnes y échappant acquièrent une immunité les protégeant des épidémies ultérieures. Au XVe siècle apr. J.-C., la technique de variolisation est utilisée en Chine pour se protéger de la variole. Elle consistait à tremper une plume dans le pus d’une pustule d’une personne infectée et de l’introduire dans une scarification d’une personne saine pour l’immuniser. Au XIXe siècle, Louis Pasteur a créé un vaccin thérapeutique contre la rage.
Coévolution hôte/pathogène
La coévolution est une évolution réciproque entre deux espèces (Figure1). Entre un hôte et un pathogène la coévolution est dite antagoniste. Seuls les protagonistes adaptés survivent aux contraintes imposées par l’autre (pression de sélection), c’est la théorie de la reine rouge (ou course aux armements).
Le pathogène survit en évoluant par la modification de traits d’histoires de vie, caractères ayant un effet soit sur sa survie soit sur sa reproduction c’est-à-dire sur sa fitness. Un caractère peut être bénéfique pour un organisme quand il augmente sa fitness, ou inversement il peut être coûteux, s’il la diminue. Il existe donc un compromis évolutif, appelé trade-off, entre deux caractères qui dépendent du rapport coût/bénéfice[2].
Le système immunitaire de l’hôte va engendrer une pression de sélection sur certains traits d’histoire de vie du pathogène, notamment la virulence et la croissance[3]. La croissance d’un pathogène correspond à sa reproduction et donc au nombre de descendants qu’il produit.
Les souches pathogènes produisent d’autant plus de formes de transmission et résistent d’autant plus longtemps à l’immunité de l’hôte qu’elles sont virulentes[1]. En d’autres termes, plus le pathogène est virulent, plus le système immunitaire a du mal à l’éliminer et plus il se transmet dans la population. Cependant, une trop forte virulence peut induire la mort de l’hôte et l’arrêt total de transmission[4]. Il existe donc un trade-off entre virulence et transmission du pathogène. La sélection naturelle va favoriser les souches ayant le meilleur compromis évolutif, c’est-à-dire qui maximisent les bénéfices et minimisent les coûts[1]. Le pathogène acquiert une densité suffisante pour infecter un maximum d’individus. Cependant, il existe un seuil de densité, appelé "densité létale" qui correspond à une densité trop forte en pathogènes pour que l'hôte survive[4].
Un pathogène peut avoir un faible taux de croissance et sera éliminé rapidement par le système immunitaire de l’hôte. Un pathogène ayant une croissance dite "intermédiaire", aura une croissance assez rapide pour atteindre une densité de population suffisante pour se transmettre de manière optimale, sans pour autant atteindre le seuil de densité létale pour l’hôte. Cette stratégie est évolutivement stable. Un pathogène ayant un taux de croissance élevé risque cependant d'atteindre très rapidement la densité létale pour l'hôte, par conséquent, l'hôte meurt dans de brefs délais diminuant fortement la transmission du pathogène[4] - [5]
Exemple du virus de la Myxomatose
Répandu en 1950 dans une population de lapins d’Australie et de Grande-Bretagne, le virus de la Myxomatose fut extrêmement virulent. Puis au cours de la décennie suivante, son niveau de virulence a évolué en un niveau intermédiaire. Les chercheurs ont trouvé que le virus avec la meilleure fitness était celui avec une virulence intermédiaire[2].
L’optimum de virulence dépend de différents facteurs tels que l’interaction entre le pathogène et son hôte, la durée de vie de l’hôte ou encore l’efficacité du système immunitaire. Dans le cas d’une infection multiple, les pathogènes sont en compétition interspécifique pour les ressources qu’ils peuvent tirer de l’hôte. Dans ce cas-là, la virulence aura tendance à augmenter, et le plus virulent sera sélectionné[2] - [5].
Echelle d’évolution
Les changements évolutifs du pathogène se déroulent au moins à deux échelles : à l’échelle d’un hôte et à l’échelle de la population[6] - [7]. Pour le cas du VIH par exemple, l’évolution a lieu à l’échelle de l’hôte. Le pathogène échappe rapidement au système immunitaire en développant des mécanismes de résistance tel que la modification de certains de ces antigènes afin de ne pas être reconnu par les lymphocytes. À l’échelle de la population on peut citer l’exemple des épidémies de grippe[7].
Limite de la vaccination
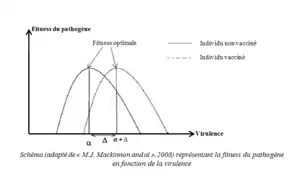
La virulence intrinsèque est la virulence observée si le pathogène infectait un hôte naïf, en quelque sorte c’est la virulence de base pour un pathogène donné. La virulence réalisée est celle observée chez un hôte ayant un niveau d’immunité donné[2].
L’hôte immunisé peut mieux se défendre contre un pathogène ayant une certaine virulence intrinsèque "α", et reste donc plus longtemps en vie. Le pathogène peut alors devenir encore plus virulent tout en minimisant ses coûts. La virulence intrinsèque du pathogène va donc augmenter[2].
Par exemple, soit un pathogène résidant ayant une virulence intrinsèque "α" correspondant à une fitness "W" optimale. Lors de l’infection d’un hôte vacciné, celui-ci sera plus résistant à la virulence du pathogène. Par conséquent, le pathogène va augmenter sa virulence d’un niveau "∆" sans que sa fitness ne soit affectée pour essayer de contourner la réaction immunitaire de l’hôte. Ainsi sa nouvelle virulence intrinsèque devient "α+Δ" pour une même fitness optimale[2](Figure 2)
Sachant cela, dans les populations partiellement vaccinées, les individus non vaccinés sont donc confrontés à un pathogène beaucoup plus virulent qu’il ne l’était au départ[8] - [5] - [9].
Dans le cas de la maladie de Marek touchant les poules, le virus jusqu'en 1950 était peu virulent, et rarement mortel. À partir de 1950, de nouvelles souches pathogènes de plus en plus virulentes sont apparues à la suite de l’application de nouveaux vaccins[10]. Aujourd'hui, le pathogène entraîne la mort de 100 % des oiseaux non vaccinés et est beaucoup plus virulent, causant plus de dommages chez les oiseaux vaccinés. Dans cet exemple, les spécialistes insistent sur le fait que la vaccination peut être à l'origine de l'évolution de la virulence de ce pathogène[3]. Normalement, la vaccination vise à empêcher la transmission de l’agent virulent, mais dans le cadre de cette maladie, le vaccin qui en général cherche à réduire la viabilité du pathogène, le rend encore virulent pour pouvoir résister et persister au sein de l'hôte[10].
Notion de vaccins imparfaits
Les vaccins ne sont jamais parfaits. En effet, une protection optimale pour une large population n’est quasiment jamais atteinte en raison de nombreux facteurs influençant l’efficacité des vaccins comme une mauvaise administration, une immaturité immunitaire de l’hôte ou encore le développement d'une résistance aux vaccins[11]. Les vaccins qui contrôlent les manifestations cliniques d’une maladie sans empêcher totalement l’infection, la réplication et la transmission du pathogène sont qualifiés de vaccins imparfaits et peuvent ainsi permettre la circulation de souches plus virulentes[9] - [11].
Les vaccins imparfaits mènent à des taux de virulence intrinsèques plus élevés et entraînent des dommages plus importants chez les hôtes non vaccinés. Au cours de l’évolution, ces vaccins ont eu un impact négatif sur une grande population en modifiant le taux de mortalité global[1].
Notion de résistance
Des mécanismes de résistance peuvent être sélectionnés à la suite de la vaccination comme la production de substances qui augmentent l’immunodéficience de l’hôte, ou la modification d’antigènes à la surface du pathogène[3].
La notion de résistance notamment dans le cas des virus est également très importante. En effet, les virus possèdent un fort taux d’erreur de réplication[11]. Ayant donc un fort potentiel de mutations pouvant souvent contourner les obstacles mis en place par le système immunitaire. Ceci conduit à l'apparition de “mutants escape”, modifiés au niveau de l’épitope[8], qui sont des mutants adaptés aux vaccins pouvant envahir l'hôte et contrer sa défense. Les gènes codants des épitopes du pathogène sont altérés, ainsi la structure de la protéine varie de la version initiale, de cette façon les mutants ne sont plus reconnus par le système immunitaire de l’hôte[3].
Dans l'exemple de la fièvre aphteuse causée par un pathogène infectant les animaux, un motif d’acides aminés « RGD » très conservé et localisé dans la protéine de la capside, permet au pathogène de s’ancrer aux cellules de l’hôte et de les infecter. Cependant les vaccins anti-RGD[11] ont fait apparaitre plusieurs mutations de ce motif, permettant ainsi au pathogène d’échapper à la reconnaissance du système immunitaire[11].
Impacts selon les types de vaccins
Le cycle d’un pathogène peut se décomposer en trois grandes étapes : L’infection de l’hôte, la croissance au sein de ce dernier puis la transmission à un autre individu qui sera le nouvel hôte[1]. L’intérêt pour le pathogène n’est pas de tuer son hôte, car à la suite de sa mort, le pathogène ne pourra plus se transmettre. Le pathogène acquiert donc une virulence intermédiaire qui lui permet d’avoir un taux de transmission maximal sans tuer son hôte[12].
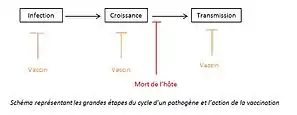
Les vaccins peuvent agir sur les différentes étapes du cycle de vie du pathogène[1] (Figure 3). Cependant, si le vaccin est focalisé sur une étape du cycle, le pathogène va tenter de contourner cet obstacle en optimisant une autre étape du cycle[1] - [12].
Vaccins anti-croissance
Le but de ce type de vaccin est de bloquer la croissance du pathogène grâce au système immunitaire[1], pour éviter qu’il n’atteigne une trop forte densité au sein de l’hôte vacciné. Ainsi il ne peut théoriquement pas atteindre le seuil de densité létale.
De ce fait, on peut observer une diminution de la virulence lorsque le vaccin est très efficace ainsi qu’une plus faible transmission, car la durée d’infection serait plus courte chez les hôtes vaccinés donc le pathogène aurait moins de temps pour se transmettre.
Cependant, le pathogène va avoir tendance à évoluer vers une croissance plus rapide chez les hôtes vaccinés, pour contrer la réaction immunitaire. En résumé, plus le nombre de personnes vaccinées dans la population est important, plus l’évolution va sélectionner les pathogènes ayant une croissance plus rapide et qui échappent donc au système immunitaire[12].
La proportion de personnes vaccinées et l’efficacité du vaccin joueraient sur l’évolution de la virulence, du taux de transmission et de croissance. Il faut savoir que le pathogène essaye toujours de s’adapter à l’hôte le plus abondant dans la population pour survivre (s’il s’adapte à un hôte peu représentatif de la population, il se transmettra moins et sera contre sélectionné). Concernant les vaccins anti-croissance, lorsque la proportion de personnes vaccinées dans la population est faible, le pathogène aura un taux de croissance ni trop élevé pour ne pas causer la mort de l’hôte (trop rapidement tout du moins) ni trop faible pour ne pas être éliminé par le système immunitaire avant d’être transmis. S’il s’adapte aux hôtes vaccinés, il va chercher à augmenter son taux de croissance pour les raisons évoquées précédemment. Cependant, il sera plus virulent pour les personnes non vaccinées. Enfin, pour une proportion d’hôtes vaccinés importante, la virulence sera plus faible[12].
Vaccins anti-transmission
Le but de ce type de vaccin est de diminuer la transmission du pathogène dans la population[1]; Ce vaccin n’empêche pas l’individu vacciné d’être infecté mais diminue le risque de transmission à autrui. De cette manière, les vaccins anti-transmission diminuent la fitness du pathogène lorsqu’il infecte des hôtes vaccinés : moins de pathogènes seront transmis à d’autres organismes et si le vaccin anti-transmission est très efficace, cela peut conduire à la disparition du pathogène au sein de la population si celui-ci ne peut plus infecter d’hôte. Cependant, agir sur une étape du cycle d’un pathogène se répercute sur les autres étapes[1]. Dans ce cas-là, pour pallier la diminution du taux de transmission, le pathogène va évoluer vers un taux de croissance plus rapide[8]. Du point de vue du pathogène, un défaut de transmission peut être dû au fait que le pathogène soit éliminé trop tôt par le système immunitaire, ce qui impacte sa transmission. Il a donc tout intérêt à croître plus vite pour être transmis en plus grande quantité avant d’être éliminé. Par conséquent, plus le vaccin bloque la transmission du pathogène, plus le pathogène évoluera dans le sens d’une croissance rapide. De plus, ce type de vaccin conduit également à une augmentation de la virulence par rapport aux hôtes qui n’ont pas été vaccinés[12]. En effet, nous avons vu précédemment que les vaccins anti-transmission ne protègent pas de l’infection en elle-même. Une fois que l’hôte vacciné est infecté, le pathogène peut évoluer dans l’organisme, en augmentant son taux de croissance comme expliqué ci-dessus. Ces changements peuvent conduire à une augmentation des effets du pathogène sur son hôte et par conséquent cela augmente sa virulence.
Dans la population actuelle, il existe des individus vaccinés et d’autres non vaccinés. Si le pathogène évolue au sein d’un individu vacciné, celui-ci peut devenir plus virulent. Le vaccin ne bloquant pas à 100 % la transmission, il est possible que le pathogène arrive à infecter un hôte non vacciné. Par conséquent, les effets du pathogène pourraient être plus forts chez cet hôte non vacciné et le risque de mortalité plus élevé. Cependant, si l’hôte meurt, le pathogène ne peut plus être transmis. En résumé, plus le nombre de personnes vaccinées dans la population est élevé, plus le taux de transmission diminue mais le pathogène risque d’augmenter son taux de croissance et sa virulence[12].
Autres types de vaccins
Il existe aussi des vaccins anti-toxine[1]. Ce type de vaccin diminue l’effet toxique en réduisant la production de toxines lorsque le pathogène a infecté un individu. Cela permet de diminuer les symptômes de la maladie. Il a été observé que la virulence intrinsèque diminue dans le cas de ce type de vaccins[1]. De plus, des vaccins anti-infection ont été développés. Le but de ce type de vaccin est de diminuer la probabilité d’être infecté lorsqu’on a été vacciné. Puisqu’ils protègent de l’infection, ils vont donc avoir tendance à diminuer la virulence du pathogène[2] puisqu’il sera moins présent dans la population.
Cas du paludisme
Un enjeu actuel est le développement d'un vaccin anti-paludique puisque le paludisme est actuellement l'une des maladies causant le plus de décès au monde. Ce modèle est actuellement étudié puisque les expériences précédentes ont montré que les ébauches de vaccins entraînaient une augmentation de la virulence[2] - [8]. L’évolution de la virulence dans le cas du paludisme est plutôt semblable à celle de la maladie de Marek, étant donné que les pathogènes encore plus virulents sont favorisés et ainsi très adaptés à l’hôte. La conséquence de cette évolution est observable en termes de plus de transmission du parasite au sein de l’hôte vacciné ou non vacciné, menant ainsi à des individus encore plus contaminés, voire un degré de guérison réduit[10].
Le développement du vaccin contre le paludisme se focalise sur trois étapes de la vie du pathogène : stades sporozoïtes qui pénètrent dans les cellules du foie, stades mérozoïtes infectant les globules rouges et stades gamétocytes, gamètes ainsi qu'oocystes[1]. L’utilisation de vaccins anti-infection et anti-transmission réduit la virulence et par conséquent la prévalence du paludisme c’est-à-dire le nombre de personnes malades dans la population. En revanche, les vaccins anti-croissance et anti-toxine n'ont pratiquement aucun effet sur la prévalence et empêche l'évolution vers de fortes virulences. Quant au vaccin combiné (vaccin anti-infectieux et anti-transmission), il reste le plus efficace. Cependant, le pathogène responsable de la maladie est très polymorphe, rendant la création d'un vaccin efficace à long terme compliquée[1].
Ouverture
Prévoir l’évolution de la virulence d'un pathogène reste difficile. Les scientifiques se basent sur l'évolution de la fitness du pathogène qui est liée à son hôte et à son environnement. D'après les différentes études, la virulence, la transmission et la persistance du pathogène au sein de l'hôte sont dépendants entre eux. La solution notamment pour l'étude de certaines maladies comme le paludisme, serait de combiner plusieurs types de vaccins afin d'améliorer l'efficacité de leur action et de réduire la virulence du pathogène tout en empêchant son évolution[1]. La prévention et l’hygiène restent les meilleurs moyens pour lutter contre la propagation des pathogènes[2] - [9], notamment pour éviter l'usage de vaccins qui accentuent la pression de sélection vers les souches les plus virulentes. Dans l'exemple du paludisme, l'utilisation de moustiquaires ou de médicaments préventifs permettent de diminuer les risques de propagation et d'infection[2]. La fabrication d'un vaccin doit nécessiter l'étude de son effet sur l'évolution de divers traits d'histoire de vie d'un pathogène avant d'être approuvée. Dans le domaine vétérinaire, et surtout dans les élevages, les vaccins permettent de réduire les symptômes mais ne protègent que très rarement contre l'infection, impliquant le maintien du pathogène dans les populations animales infectées[11]. Ceci peut avoir un impact dangereux sur les populations humaines puisque les scientifiques ont démontré que de nombreuses épidémies proviennent de pathogènes infectant à l'origine des animaux et plus particulièrement les mammifères devenant par la suite des pathogènes zoonotiques.
Futurs vaccins
Les vaccins modernes sont composés de microorganismes inactivés, administrés par une injection stérile. De nos jours, les vaccins contiennent une faible quantité d’un antigène qui entraine la production d’anticorps spécifiques à ce dernier[7]. Dans un futur proche, les chercheurs envisagent un nouveau type de vaccination “par ADN”[7]. Les gènes codant un antigène provenant d'un pathogène sont injectés dans les cellules immunitaires qui produisent ainsi l’antigène et le présentent à la surface par leur CMH (Complexe majeur d'histocompatibilité). La vaccination génétique qui utilise de l’ADN plasmidique et des vecteurs transgéniques atténués, est une de ces nouvelles méthodes[7].
Notes et références
- Sylvain Gandon, Margaret J. Mackinnon, Sean Nee et Andrew F. Read, « Imperfect vaccines and the evolution of pathogen virulence », Nature, vol. 414, , p. 751-756
- M.J. Mackinnona, S. Gandonc et d, A.F. Reade, « Virulence evolution in response to vaccination : The case of malaria », Vaccine, vol. 26,Supplement 3, , C42–C52
- Andrew F. Read et Margaret J. Mackinnon, « Pathogen evolution in a vaccinated world », in Evolution in health and disease 2, vol. 26, , p. 139-152
- Vitaly V.Ganusov et Rustom Antia, « Imperfect Vaccines and the Evolution of Pathogens Causing Acute Infections in Vertebrates », Evolution, vol. 60, Issue 5, , p. 957-969
- Dieter Ebert et James J. Bull, « Challenging the trade-off model for the evolution of virulence: is virulence management feasible? », Trends in Microbiology, vol. 11, Issue 1, , p. 15–20
- Michael A. Gilchrist et Daniel Coombs, « Evolution of virulence: Interdependence, constraints, and selection using nested models », Theoretical Population Biology, vol. 69.2, , p. 145-153
- T Day, A Galvani, C Struchiner et A Gumel, « The evolutionary consequences of vaccination », Vaccine, vol. 26, , C1-C3
- Victoria C. Barclay, Derek Sim, Brian H. K. Chan, Lucas A. Nell, Maia A. Rabaa, Andrew S. Bell, Robin F. Anders et Andrew F. Read, « The Evolutionary Consequences of Blood-Stage Vaccination on the Rodent Malaria Plasmodium chabaudi », PLOS Biology, vol. 10, Issue 7, 10.7, , e1001368
- AndrewF.Read, SusanJ.Baigent, ClairePowers, LydiaB.Kgosana, LukeBlackwell, LorraineP.Smith,DavidA.Kennedy, StephenW.Walkden-Brown, VenugopalK. Nair, « Imperfect Vaccination Can Enhance the Transmission of Highly Virulent Pathogens », PLOS Biology, vol. 13.7, , e1002198
- Sylvain Gandon, Troy Day, « Evidences of parasite evolution after vaccination », Elsevier, Vaccine, vol. 26, , C4-C7
- K.A. Schat, E. Baranowski, « Animal vaccination and the evolution of viral pathogens », Rev. sci. tech. Off. int. Epiz, vol. 26.2, , p. 327-338
- Vitaly V.Ganusov and Rustom Antia, « Imperfect Vaccines and the Evolution of Pathogens Causing Acute Infections in Vertebrates », Evolution, vol. 60, Issue 5, , p. 957-969