Spermatogenèse humaine
Chez les humains, la spermatogenèse, c'est-à-dire le processus de production des spermatozoïdes, a lieu dans les tubes séminifères des testicules. Elle englobe les phénomènes qui, des spermatogonies, cellules souches diploïdes (2n chromosomes), aboutissent aux spermatozoïdes, gamètes mâles haploïdes (n chromosomes).
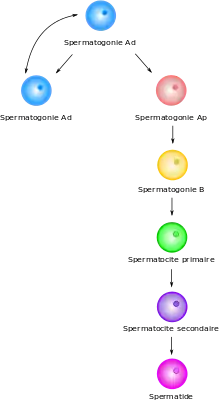
La spermiogenèse, dernière phase de la spermatogenèse, est quant à elle la différenciation des spermatides en spermatozoïdes.
Dès les années 1970, les spécialistes constatent une dégradation de la spermatogenèse dans les pays riches (Europe, États-Unis, Japon). Ils ont d'abord observé des différences significatives de qualité de sperme selon la région étudiée, puis des comparaisons temporelles ont montré que, dans tous les cas étudiés, le nombre moyen de spermatozoïdes par millilitre de sperme diminue d'année en année. Il a été divisé par deux en environ 50 ans.
Introduction
La spermatogenèse débute à la puberté, atteint son maximum vers 20–30 ans, ralentit progressivement vers la quarantaine mais peut se poursuivre jusqu'à un âge avancé. La spermatogenèse est un processus lent et continu demandant 74 jours environ chez l'homme ; elle se déroule par poussées ou vagues successives dans les tubes séminifères. Cela dit, un début de spermatogenèse (apparition de spermatogonies et de quelques spermatocytes 1) a lieu dans la période comprise entre le stade embryonnaire et la naissance.
Schéma général
Regardez l'image en haut à droite.
Tube séminifère
Le tube séminifère est limité par une gaine tubulaire mince formée de la lame ou membrane basale, de fibroblastes. Certains de ces fibroblastes contiennent des filaments contractiles et des fibres de collagène et constituent les cellules myoïdes ou myofibroblastes :
- La gaine tubulaire est appelée membrane propre du tube séminifère ou membrana propria.
- Ces tubes sont entourés de tissu conjonctif (de « remplissage ») et aussi de tissu interstitiel formé de cellules de Leydig qui est parcouru par des artérioles et veinules apportant l'oxygène. (v. testicule) Ces cellules endocrines ou cellules de Leydig sécrètent essentiellement de la testostérone (et de la dihydrotestostérone) ; elles constituent la glande interstitielle du testicule.
- La paroi du tube séminifère est formée d'un épithélium stratifié comprenant deux types de cellules
- Les cellules de la lignée germinale disposées sur 4 à 8 couches
- Les cellules de Sertoli, cellules hautes s'appuyant sur la membrane basale et atteignant la lumière du tube par leur pôle apical
- Dans les tubes séminifères adultes, les différentes couches de cellules germinales représentent les phases de la spermatogenèse qui s'effectuent de façon centripète, depuis la spermatogonie située contre la membrane basale jusqu'au spermatozoïde libéré dans la lumière : sous le microscope, on observe que ces tubes sont « remplis » de cellules apparemment différentes, organisées en anneaux. À la périphérie, on trouve des cellules souches (spermatogonies), tandis qu'au centre se trouvent les spermatozoïdes. En fait, les cellules non différenciées se développent pour finalement devenir des gamètes mâles :
Spermatogenèse
Tout d'abord, à travers de multiples mitoses, à partir d'une spermatogonie, on en obtient un stock. Puis la spermatogonie grandit et devient spermatocyte I. À ce stade, ce sont toujours des cellules souches avec 2n chromosomes. La méiose des spermatocytes I produit des spermatocytes II qui n'ont plus que n chromosomes (v. méiose). La suite de la méiose conduit à des spermatides qui migrent vers la lumière du tube. La différenciation de ceux-ci donne finalement le spermatozoïde, au centre du tube. On dit donc que la spermatogenèse est centripète.
Ce processus est continu, c'est-à-dire que les cellules se transforment successivement et sont remplacés par de nouvelles spermatogonies obtenues par mitose.
Dans les tubes séminifères, on remarque aussi la présence de grandes cellules, les cellules de Sertoli, qui soutiennent et nourrissent les spermatogonies et qui sont donc indispensables à la spermatogenèse.
Les tubes séminifères conduisent les spermatozoïdes nouvellement formés, par un système de drainage, au canal épididymaire dans lequel ils poursuivent leur maturation puis sont propulsés dans le canal déférent et mélangés avec un ensemble de sécrétions provenant des glandes séminales, de la prostate et des glandes bulbo-urétrales pour former le sperme lors de l'éjaculation ou éjaculat.
Hormones
Trois hormones jouent un rôle important lors de la spermatogenèse :
- La testostérone
- LH (hormone lutéinisante)
- FSH (hormone folliculostimulante)
LH et FSH sont produites par l'hypophyse tandis que la testostérone est produite dans les cellules de Leydig.
La FSH agit directement sur les spermatogonies et les cellules de Sertoli pour accélérer la spermatogenèse (par assimilation augmentée de testostérone). La LH, quant à elle, augmente la production de testostérone qui agit également sur les spermatogonies (et permet en particulier la différenciation finale) et sur les cellules de Sertoli. Si la production de testostérone atteint un certain seuil, la testostérone envoie un rétrocontrôle négatif à l'hypophyse qui inhibe la production de LH. De même, les cellules de Sertoli produisent une hormone, l'inhibine, qui, en cas d'élévation de production de spermatozoïdes, agissent par rétrocontrôle négatif sur l'hypophyse. C'est donc un système autorégulé qui ne permet pas la production excessive de testostérone, et donc de spermatozoïdes.
Thermodépendance
La production de spermatozoïdes ne peut se faire qu'à une température inférieure à celle du reste du corps, généralement 37 °C. La position des testicules éloignée du corps dans le scrotum permet de les maintenir à environ 35 °C.
Les testicules sont logés dans le scrotum, composé de 7 couches dont 2 musculaires :
- le dartos est la couche musculaire la plus externe du scrotum et est responsable de la contraction de la peau pour réduire la perte de température ;
- le crémaster est la couche musculaire la plus profonde et est responsable de l'élévation des testicules.
Les muscles dartos et crémaster font monter et contracter le scrotum pour maintenir une température constante. Il y a aussi une vasorégulation des artères et des veines de la région pour maintenir la bonne température.
La spermatogenèse est sensible à toute élévation de température qui a pour conséquence de la freiner[1]. Au cours du développement embryonnaire, les testicules s'éloignent de la cavité abdominale et descendent jusqu'à pénétrer dans le sac scrotal. Si cette descente est incomplète on parle de cryptorchidie et cela a des conséquences négatives sur la fertilité.
C'est ce phénomène qui a permis de développer la contraception masculine thermique[2].
Délétion de la spermatogenèse
Dès les années 1970, des spécialistes s'étonnent de différences significatives de qualité de sperme, selon la région de provenance du patient ou du donneur.
10 ans plus tard, de premiers lanceurs d'alerte confirment ces disparités, et notent que l'analyse des comptages de spermatozoïdes fait de 1935 à 1980 révèlent toutes un déclin du nombre de spermatozoïdes, dans toutes les régions étudiées, y compris chez les jeunes hommes.
Plus d'une soixantaine d'études (en Europe, Amérique du nord et Japon essentiellement) laissent penser qu'au moins dans les pays occidentaux, les hommes sont confrontés à un problème général de dégradation de leur spermatogenèse. L'ampleur du phénomène, ses causes et sa traduction en termes de fertilité masculine font encore l'objet de controverses ; Ceci laisse penser qu'il existe des causes environnementales et qu'il s'agit d'un discret mais important problème de santé publique.
Le fait que les jeunes hommes soient également touchés, et la progression de cancers « hormonaux » ainsi que l'avancée des connaissances sur les perturbateurs endocriniens ont invité les scientifiques à chercher des causes possibles dès le stade périnatal du développement testiculaire, et en particulier concernant le nombre ou la qualité des cellules de Sertoli alors affectées de manière probablement irréversibles. D'autres effets, probablement plus réversibles, sont recherchés sur la spermatogenèse chez l'adulte non touché in utero.
Certains facteurs liés au mode de vie (sédentarité, obésité, tabagisme, alcoolisme, vêtements serrés ou conservant les testicules trop au chaud…) sont jugés potentiellement dommageables pour la fertilité masculine[3]. Des facteurs environnementaux (exposition de l'enfant ou de l'adulte à certains polluants émis avec les gaz d'échappement, aux dioxines, ou à d'autres produits de combustion, certains pesticides…) peuvent négativement affecter les fonctions testiculaires (aux stades périnatal et adulte)[3]. Certains produits chimiques désormais largement présents dans l'environnement (pesticides, additifs alimentaires, hormones contraceptives, polluants persistants comme le DDT, furanes, dioxines ou PCB) ont des effets jugés préoccupants sur la santé reproductive, mais encore mal compris et dont les proportions ou synergies sont mal mesurées[3].
En France, par exemple, d'après les comptages de spermatozoïdes de 1 351 donneurs de spermes du CECOS parisien, il n'y a pas eu de changement dans le volume de sperme moyen produit sur environ 20 ans, de 1973 à 1992, mais la concentration moyenne de spermatozoïdes a par contre fortement diminué (- 2,1 % /an, chutant de 89 × 106 /ml de sperme en 1973 à 60 × 106 par ml en 1992[4].
Une étude israélienne évalue à 60 % la baisse du nombre total de spermatozoïdes chez les hommes d'Europe, d'Amérique du Nord, d'Australie et de Nouvelle Zélande entre 1973 et 2011.
Dans le même temps, le pourcentage de spermatozoïdes normalement mobiles chutait de 0,6 % par an et celui des spermatozoïdes de forme normale diminuait de 0,5 % par an[4].
Après ajustement prenant en compte l'âge et la durée de l'abstinence sexuelle, sur ces 20 ans, chaque nouvelle génération (par année civile de naissance) a perdu 2,6 % des spermatozoïdes de la cohorte née l'année précédente, et le taux de spermatozoïdes mobiles a diminué de 0,3 % par an, et celui des spermatozoïdes de forme normale a diminué de 0,7 %/an[4].
Notes et références
- (en)MIEUSSET R., BUJAN L. : The potential of mild testicular heating as a safe, effective and reversible contraceptive method for men. Int. J. Androl., 1994 ; 17 : 186-191.
- « Méthode thermique | » (consulté le )
- (en) Richard M. Sharpe « Environmental/lifestyle effects on spermatogenesis » Philosophical Transaction of the Royal Society / Biological SciencesB 2010/05/27 ; vol. 365 no 1546 1697-1712 DOI 10.1098/rstb.2009.0206 (Résumé).
- (en) J Auger, J M Kunstmann, F Czyglik, P Jouannet, « Decline in semen quality among fertile men in Paris during the past 20 years », The New England journal of medicine, vol. 332, no 5, , p. 281-285 (ISSN 0028-4793, PMID 7816062, DOI 10.1056/NEJM199502023320501, lire en ligne, consulté le ).
Voir aussi
Article connexe
Systèmes et organes du corps humain
Liens externes
- « Résumé avec schémas », sur www.ac-versailles.fr (version du 4 mars 2009 sur Internet Archive)
- « Principes d'endocrinologie. La spermatogenèse », sur emcom.ca (version du 2 décembre 2011 sur Internet Archive), site Internet d'information sur les perturbeurs endocriniens
- HAS
Bibliographie
- Katsuhiko Itoh et al., « Dephosphorylation of protamine 2 at serine 56 is crucial for murine sperm maturation in vivo », Sci. Signal, vol. 12, no 574, (DOI 10.1126/scisignal.aao7232, lire en ligne)