Site interstitiel
Dans un cristal, des motifs (atomes, ions ou molécules) sont situés aux nœuds d'un réseau. L'espace entre ces motifs est appelé sites interstitiels.
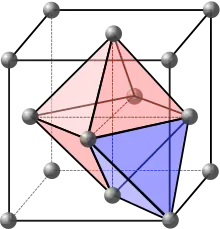
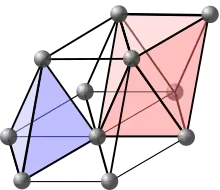
Des atomes étrangers peuvent se glisser dans ces interstices, on parle alors de solution solide interstitielle (voir aussi défaut ponctuel).
En faisant référence aux nœuds les plus proches du site, on distingue principalement :
Empilements compacts
Les empilements compacts (en particulier hexagonal compact et cubique à faces centrées) sont ceux pour lesquels les atomes sont le « plus serrés », pour qu'un empilement soit considéré comme compact, il faut que la compacité atteigne environ 74 %. On distingue alors deux types de sites, les sites octaédriques et tétraédriques, comme illustré sur les schémas ci-contre.
Réseaux cubiques
Les réseaux cubiques primitifs ont des sites cubiques (au centre de chaque maille).
Les réseaux cubiques centrés ont des sites interstitiels qu'on peut considérer comme octaédriques (au centre de chaque face, il est à noter cependant que pour ces sites, les 6 plus proches voisins ne sont pas tous aussi proches).
Les réseaux cubiques à faces centrées sont des empilements compacts. On retrouve donc :
- des sites octaédriques : au milieu de chaque arête et au centre de la maille ;
- des sites tétraédriques : au centre des tétraèdres formés par chaque sommet et ses trois plus proches nœuds voisins au centre des faces.