Réarrangement diénone-phénol
Un réarrangement diénone-phénol est une réaction organique publiée par les chimistes allemands Karl von Auwers et Karl Ziegler en 1921[1]. Un exemple bien connu de ce type de réactions est le réarrangement d'une cyclohexadiénone 4,4-disubstituée en phénol 3,4-disubstitué stable en présence d'un acide. Une réaction semblable est possible avec une cyclohexadiénone 2,2-disubstituée en son phénol disubstitué correspondant. Ce genre de réarrangement est généralement spontané à moins que déplacement d'un substituant en position 3 soit bloqué par un substituant déjà en place[2].
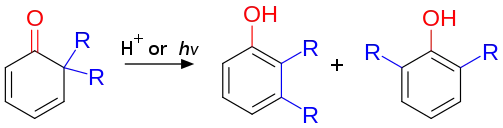 (en) Réarrangement d'une cyclohexadiénone 4,4-disubstituée en haut, et 2,2-disubstituée en bas.
(en) Réarrangement d'une cyclohexadiénone 4,4-disubstituée en haut, et 2,2-disubstituée en bas.
Le mécanisme réactionnel de ce réarrangement est décrit en quatre étapes[3], représentées ci-dessous :
La 2,5-cyclohexadién-1-one 4,4-disubstituée (1) est protonée pour donner un ion oxonium réactif (2). La charge positive se propage ensuite à l'atome de carbone en position 1 (3) jusqu'à l'atome en position 4, induisant le réarrangement de l'un des deux subsituants, la molécule étant finalement stabilisée par déprotonation (4).
La mobilité différentielle des couples de substituants en position 4,4 ou en position 2,2 peut être déterminée en comparant la stabilité relative des carbocations intermédiaires formés au cours des réarrangements. En condition acide, on a par exemple observé les mobilités relatives suivantes : COOEt > phényle ou alkyle[4] ; phényle > méthyle[5] ; vinyle > méthyle[6] ; méthyle > alcoolate et alcoolate > phényle[7].
Notes et références
- (de) K. v. Auwers et K. Ziegler, « Über Kohlenwasserstoffe der Semibenzolgruppe », Justus Liebigs Annalen der Chemie, vol. 425, no 3, , p. 217-280 (DOI 10.1002/jlac.19214250302, lire en ligne)
- (en) Zerong Wang, « Dienone‐Phenol Rearrangement », Comprehensive Organic Name Reactions and Reagents, John Wiley & Sons, 2010, p. 900. (ISBN 978-0-470-63885-9)
- (en) Zerong Wang, Comprehensive organic name reactions and reagents, vol. 1, John Wiley, 2009, p. 897-899. (ISBN 978-0-470-28662-3)
- (en) Jacques Kagan, Dalmacio A. Agdeppa Jr., S. P. Singh, David A. Mayers, Charles Boyajian, Carol Poorker et Bruce E. Firth, « Molecular rearrangements with ethoxycarbonyl group migrations. 1. The rearrangement of epoxides », The Journal of the American Chemical Society, vol. 98, no 15, , p. 4581-4588 (DOI 10.1021/ja00431a042, lire en ligne)
- (en) Richard T. Arnold et Jay S. Buckley, « The Dienone-Phenol Rearrangement. II. Rearrangement of 1-Keto-4-methyl-4-phenyl-1,4-dihydronaphthalene », The Journal of the American Chemical Society, vol. 71, no 5, , p. 1781-1784 (DOI 10.1021/ja01173a071, lire en ligne)
- (en) John N. Marx et Young Sook Paik Hahn, « Acid-catalyzed migration of the vinyl substituent in the dienone-phenol rearrangement », The Journal of Organic Chemistry, vol. 53, no 12, , p. 2866-2868 (DOI 10.1021/jo00247a046, lire en ligne)
- (en) H. Budzikiewicz et W. Metlesics, « Notes: Dienone-Phenol Rearrangement of 2-Phenyl-o-quinol-acetate », The Journal of Organic Chemistry, vol. 24, no 8, , p. 1125-1126 (DOI 10.1021/jo01090a603, lire en ligne)

