Réarrangement de Smiles
Le réarrangement de Smiles est une réaction de réarrangement de type substitution nucléophile aromatique intramoléculaire[1] - [2] :
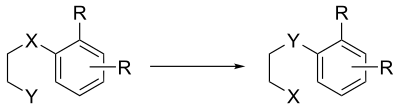
dans laquelle le X du composé aromatique peut être une sulfone, un sulfure, un éther ou tout autre substituant capable de se déloger de l'arène en portant une charge négative. Le groupe fonctionnel terminal Y doit lui être capable d'agir comme un nucléophile fort, par exemple un alcool, une amine ou un thiol.
Comme dans les autres réactions de substitution nucléophile aromatique, l'arène doit être activé par un groupe électro-attracteur, préférentiellement en position ortho.
Une réaction relativement proche est le réarrangement de Chapman.
Réarrangement de Truce-Smiles
Dans une modification de la réaction, appelée réarrangement de Truce-Smiles, le nucléophile est suffisamment fort pour que l'arène n'ait pas besoin d'activation supplémentaire ; ce peut être par exemple un organolithien. Un exemple de cette réaction est la conversion d'une arylsulfone en acide sulfinique par l'action du n-butyllithium[3] :
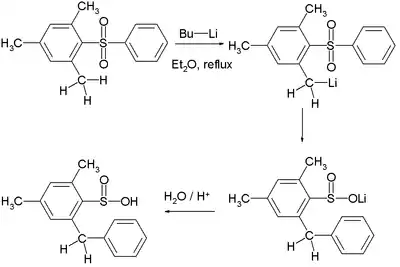
Cette réaction requiert l'interaction d'un groupe alkyllithium en ortho du groupe sulfone, ce qui s'apparente à une métallation ortho dirigée (en).
Notes et références
- Truce, W. E. ; Kreider, E. M. ; Brand, W. W., Org. React. 1970, 18.
- A. A. Levy, H. C. Rains et S. Smiles, J. Chem. Soc. 1931, 3264.
- (en) William E. Truce, William J. Ray, Oscar L. Norman et Daniel B. Eickemeyer, Rearrangements of Aryl Sulfones. I. The Metalation and Rearrangement of Mesityl Phenyl Sulfone, J. Am. Chem. Soc., 1958, 80(14), p. 3625–3629, DOI 10.1021/ja01547a038
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Smiles rearrangement » (voir la liste des auteurs).
Voir aussi
Article connexe
- Réarrangement de Chapman