Réaction de Biginelli
La réaction de Biginelli est une réaction chimique multicomposants qui crée des 3,4-dihydropyrimidin-2(1H)-ones 4 à partir de l'acétoacétate d'éthyle 1, d'un aldéhyde aromatique (tel que le benzaldéhyde 2), et l'urée 3[1] - [2] - [3] - [4]. Elle est nommée d'après le chimiste italien Pietro Biginelli[5] - [6].
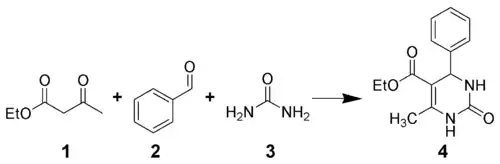
Cette réaction a été publiée pour la première fois par Pietro Biginelli en 1891. Elle peut être catalysée par des acides de Brønsted ou par des acides de Lewis tels que le trifluorure de bore[7]. Diverses méthodes de synthèse en phase solide en utilisant diverses chaînes reliant le réactif supporté à la résine[8] - [9].
Les dihydropyrimidinones, obtenues par la réaction de Biginelli, sont largement utilisés dans l'industrie pharmaceutique, notamment en tant qu'inhibiteurs calciques[10], agents anti-hypertension artérielle et antagoniste alpha-1.
Plusieurs articles de recherche récents ont eu pour objet l'amélioration de cette réaction[11] - [12].
Bilan (sans flèches)
Le mécanisme de la réaction de Biginelli implique une série de réactions bimoléculaires aboutissant finalement à la dihydropyrimidinone[13].
Selon le mécanisme proposé par Sweet en 1973, la condensation aldolique entre l'acétoacétate d'éthyle 1 et l'aldéhyde aromatique est l'étape cinétiquement limitante, ce qui aboutit au carbocation 2. L'addition nucléophile de l'urée donne l'intermédiaire 4 qui de déshydrate pour donner le produit attendu 5[14]
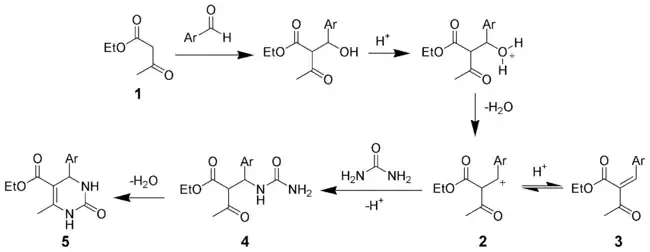
Ce mécanisme est, de nos jours, considéré comme dépassé par celui proposé par Kappe en 1997
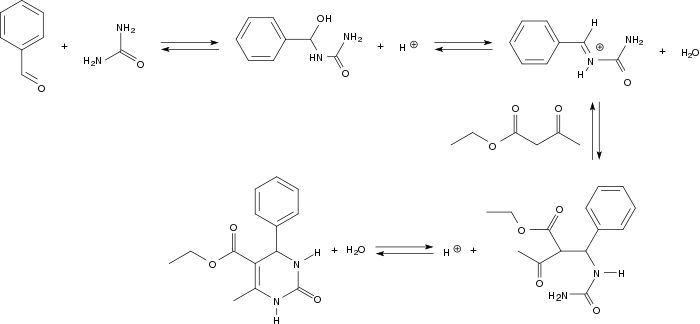
Ce mécanisme débute par une addition nucléophile cinétiquement déterminante de l'urée à l'aldéhyde[15] - [16]. L'étape de condensation suivante est catalysée par un acide pour donner une base de Schiff. L'acétoacétate d'éthyle s'additionne ensuite à la base de Schiff et le composé attendu est obtenu après attaque nucléophile de la fonction amine sur le groupe carbonyle suivie par une seconde condensation.
Notes et références
- (de) Biginelli, P. Ber. 1891, 24, 1317 & 2962.
- (de) Biginelli, P. Ber. 1893, 26, 447.
- (en) Zaugg, H. E.; Martin, W. B. Org. React. 1965, 14, 88. (Article de revue)
- (en) Kappe, C. O. Tetrahedron 1993, 49, 6937-6963. (Article de revue)
- (en) C. Oliver Kampe: The Biginelli Reaction, in: J. Zhu and H. Bienaymé (Éditeur): Multicomponent Reactions, Wiley-VCH, Weinheim, 2005, (ISBN 978-3-527-30806-4).
- (en) Kappe, C. O.; Stadler, A. Org. React. 2004, 63, 1. (doi: 10.1002/0471264180.or063.01)
- (en) Hu, E. H.; Sidler, D. R.; Dolling, U.-H. J. Org. Chem. 1998, 63, 3453-3457.
- (en) Wipf, P.; Cunningham, A. Tetrahedron Lett. 1995, 36, 7819-7822
- (en) Kappe, C. O. Bioorg. Med. Chem. Lett. 2000, 10, 49-51.
- (en) Rovnyak, G. C.; Atwal, K. S.; Hedberg, A.; Kimball, S. D.; Moreland, S.; Gougoutas, J. Z.; O'Reilly, B. C.; Schwartz, J.; Malley, M. F. J. Med. Chem. 1992, 35, 3254-3263.
- (en) O'Reilly, B. C.; Atwal, K. S. Heterocycles 1987, 26, 1185-1188 & 1189-1192.
- (en) Atul Kumar et Ram A. Muarya Tetrahedron Letters 48, 2007, 4569-4571 DOI 10.1016/j.tetlet.2007.04.130
- (en) Folkers, K.; Johnson, T. B. J. Am. Chem. Soc. 1933, 55, 3784-3791.
- (en) Sweet, F.; Fissekis, J. D. J. Am. Chem. Soc. 1973, 95, 7841-8749.
- (en) Folkers, K.; Harwood, H. J.; Johnson, T. B. J. Am. Chem. Soc. 1932, 54, 3751-3758.
- (en) Kappe, C.O. J. Org. Chem. 1997, 62, 7201-7204.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Biginelli Reaction » (voir la liste des auteurs).