Piline
La piline est la protéine principale et structurale des pili. Cette structure, facultative, se retrouve majoritairement chez les bactéries à Gram négatif, et plus rarement chez les bactéries à gram positif. La piline porte différents noms selon le type de pili dans lequel elle se trouve.
Quelques dates importantes
- 1928: premiers travaux sur la génétique bactérienne.
Frederick Griffith met en évidence la conjugaison bactérienne.
- 1984: Todd WJ et son équipe font une étude sur la morphologie et la disposition des pili chez Neisseria gonorrhoeae, par diverses techniques de microscopie électronique.
- 1995: Parge, Forest et leur équipe résolvent la structure de la piline chez Neisseria gonorrhoeae.
Mattick et son équipe étudient la génétique moléculaire des pili de type IV chez Pseudomonas aeruginosa.
- 2001: Skerker JM et son équipe observent les phénomènes d’extension et de rétraction des pili de type IV chez P. aeruginosa par microscopie à réflexion interne.
- 2003: Craig et son équipe résolvent les structures cristallines (secondaires et tertiaires) de pilines tronquées des souches PAK de P. aeruginosa.
- 2006: Craig L et son équipe étudient les fonctions des pili de type IV et l’assemblage des pilines au sein de ces derniers (structure complète tertiaire) par cryo microscopie électronique et cristallographie.
Description moléculaire de la piline
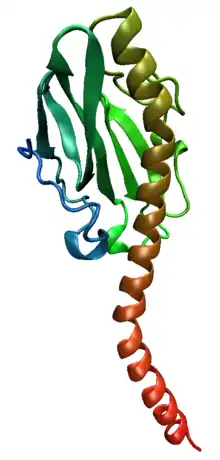
Structure générale de la piline
La piline est une protéine qui, chez Escherichia coli, à poids moléculaire égal à 17kDa, elle est composée principalement d’acides aminés polaires qui confèrent un caractère hydrophobe. Elle comporte 70 à 150 acides aminés associés à des résidus glucose et phosphate. La structure tertiaire de cette dernière est composée par l’association d’hélice α et de feuillet β antiparallèle.
La piline au sein des pili
La piline s’assemble avec des protéines chaperonne au niveau de l’espace périplasmique. Ce complexe est dirigé ensuite vers le pied d’encrage du pilus où elle s’assemblera avec d’autres monomères de piline (entourés de chaperonnes) formant ainsi un polymère qui donnera naissance en partie à la structure finale du pili. D’autres protéines entrent également en jeu dans la formation du pilus, tel que l’adésine ou des protéines mineures. On trouve plusieurs types de piline correspondant à différents types de pili, ces derniers ayant des rôles variés.
- Pili de type I : FimA
Pour le pili de type I, la piline est nommée FimA. Cette dernière est codée par le gène fimA, situé sur un opéron (opéron Fim) regroupant fimA, fimC, fimD, fimF, fimG, fimH et fimI. Lorsque cette protéine est associée à la protéine chaperonne Usher, elle donnera naissance à une structure en hélice. On peut trouver ce type de pili chez E.coli.
- Pili de type II (ou curli) : CsgA
Pour le pili de type II, la piline est nommée CsgA, de structure hélicoïdale. Elle est codée par le gène csgA situé sur un opéron (qui regroupe csgA, csgB et csgC). On peut trouver ce type de pili chez E.coli.
- Pili de type III : PrgL
Pour le pili de type III, la piline est nommée PrgL. Elle est codée par le gène prgL. On peut trouver ce type de pili chez S.typhimurium.
- Pili de type IV : PilE
Pour le pili de type IV, la piline est nommée PilE. Elle est codée par le gène pilE et forme une hélice constituée de cinq sous unités par tour, donnant une structure finale en tube droit. On peut trouver ce type de pili chez Neisseria gonorrhoeae.
- Pili Pap : PapA
Pour ce pili la piline est nommée PapA qui s’associe de façon hélicoïdale. Elle est codée par le gène papA au niveau de l’opéron pap (qui code aussi 11 gènes).
- Pili de type F (ou pili sexuel)
Pour le pili de type F, le gène codant la piline est situé sur un opéron au niveau du plasmide F.
Rôles et actions
Le rôle principal de la piline est de donner la forme et la structure des pili. En effet la présence de la piline est indispensable pour l’assemblage des différentes unités protéiques des pili, comprenant pied du pilus, piline et adésine. L’expérience de Qi Xiang-Mu et son équipe a montré que la mutation de FimA entraine la naissance de bactéries sans pili. Cela montre qu’il n’y a pas eu d’assemblage des différentes sous unités du pilus. De plus, elle a indirectement divers rôles selon les pili dans lesquels on la trouve.
- Conjugaison Bactérienne
La piline constitue un intermédiaire entre le pied du pilus de la bactérie donneuse et l’adésine située à son extrémité qui permettra l’adhésion à la bactérie receveuse. Cela conduit à la formation d’un pont par lequel passera l’information génétique. Ce mécanisme intervient dans les pili de type F (pili sexuel).
- Sécrétion
La sécrétion est une fonction des pili qui permet le passage de protéines effectrices de la bactérie vers l’extérieur (cellule hôte, environnement…) ou directement dans le cytoplasme d »une autre bactérie. . Concernant les pili de type IV, la piline forme un canal qui de par son caractère hydrophobe va permettre la formation de liaisons avec les molécules et donc leur progression au sein du pili. Ce mécanisme se produit également pour les pili de type II (formation de biofilm) et III.
- Adhésion
Dans les pili de type I, FimA s’associe à d’autres sous unités protéiques qui sont FimF, FimG et FimH. En effet ce dernier, connu sous le nom d’adésine, permet la fixation sur une cellule hôte. Ce phénomène intervient beaucoup dans les maladies causées par des bactéries (infection urinaire, colonisation du tube digestif). On retrouve ce même rôle pour le pili de type Pap qui agit pour Escherichia coli.
Pathologie : exemple de Neisseria gonorrhoeae
Neisseria gonorrhoeae, bactérie à Gram négatif pathogène est l’agent de la Gonorrhée, aussi appelée Gonoccie, une infection des organes génitaux, sexuellement transmissible.
Symptômes
Chez l’homme, cette maladie se manifeste par des douleurs mictionnelles (brûlures urinaires) et épidymaires, un écoulement de pus à l’extrémité de la verge, et d’un prurit urétral.
Chez la femme, elle se manifeste par un écoulement vaginal, une dysurie (brûlure urinaire), de saignements, de douleurs abdominales basses et d’une dyspareunie profonde (douleur lors de l’acte sexuel).
Rôle de la piline dans cette maladie
La piline, dans cette infection, va jouer le rôle de marqueur antigénique. Chez Neisseria gonorrhoeae cette protéine est codée par un gène résultant de la combinaison de plusieurs gènes : un gène actif pilE avec des gènes silencieux pilS. Il y a deux séquences, l’une codant la région constante de la piline (non antigénique), et la seconde codant la région variable (hautement antigénique) : c’est ce que l’on appelle le réarrangement spécifique de proportions de gènes. De ce fait elle est extrêmement variable. Cela modifiera donc le facteur antigénique, le rendant invisible pour les anticorps, et donc pour le système immunitaire.
De plus, la piline permet la fixation de la bactérie aux cellules épithéliales des voies urinaires et génitales. Ce mécanisme peut être bloqué par des anticorps de type IgA, or Neisseria gonorrhoeae, en sécrétant des protéases, clive les dimères d’IgA.
Le piline est une protéine structurale essentielle aux pili des bactéries. Ses rôles sont divers et elle peut être également un facteur pathogène.
Bibliographie
Cours suivis
- Cours IUT Génie biologie Clermont Ferrand, Analyses Biologiques et Biochimiques, première année, semestre 1, M. Barnich et M. Perret.
Ouvrages utilisés
- Moselio Schaechter, Gerald Medoff, Bary I.Einstein, Microbiologie et pathologie infectieuse, éd : De Boeck université 1993
- C.Nauciel et J.L Vildé, Bactériologie médicale, éd Masson, 2005
- A.Charles Janeway, P.Travers, G.Duvalie,L.Pierce Masson, Immunobiologie, éd : De Boeck, 2003
- D.Male, J.Brostoff,D.B.Roth, I.Roit, Immunobiologie, éd : Elsevier, 2007
Liens externes
- Arrangement of pili in colonies of Neisseria gonorrhoeae, PubMed U.S. National Library of Medicine National Institutes of Health, https://www.ncbi.nlm.nih.gov/sites/entrez?db=pubmed&cmd=Search&doptcmdl=Citation&defaultField=Title%20Word&term=Todd[author]%20AND%20Arrangement%20of%20pili%20in%20colonies%20of%20Neisseria%20gonorrhoeae, consulté le 21/05/2010.
- Structure of the fibre-forming protein pilin at 2.6 A resolution, PubMed U.S. National Library of Medicine National Institutes of Health, https://www.ncbi.nlm.nih.gov/sites/entrez?db=pubmed&cmd=Search&doptcmdl=Citation&defaultField=Title%20Word&term=Parge[author]%20AND%20Structure%20of%20the%20fibre-forming%20protein%20pilin%20at%202.6%20A%20resolution, consulté le 21/05/2010.
- Direct observation of extension and retraction of type IV pili, PubMed U.S. National Library of Medicine National Institutes of Health, https://www.ncbi.nlm.nih.gov/sites/entrez?db=pubmed&cmd=Search&doptcmdl=Citation&defaultField=Title%20Word&term=Skerker[author]%20AND%20Direct%20observation%20of%20extension%20and%20retraction%20of%20type%20IV%20pili,. consulté le 21/05/2010.
- Charles SABIN, « La lectine PA-IIL de Pseudomonas aeruginosa : Structure, affinité et spécificité pour des ligands naturels et glycomimétiques », thèse Biologie structurale et fonctionnelle, 2006, http://tel.archives-ouvertes.fr/docs/00/14/41/16/PDF/these-total.pdf, consulté le 14/05/2010.
- Type IV pilus structure by cryo-electron microscopy and crystallography: implications for pilus assembly and functions, PubMed U.S. National Library of Medicine National Institutes of Health, https://www.ncbi.nlm.nih.gov/sites/entrez?db=pubmed&cmd=Search&doptcmdl=Citation&defaultField=Title%20Word&term=Craig[author]%20AND%20Type%20IV%20pilus%20structure%20by%20cryo-electron%20microscopy%20and%20crystallography%3A%20implications%20for%20pilus%20assembly%20and%20functions, consulté le 21/05/2010.
- Structure and assembly of P-pili: A protruding hinge region used for assembly of a bacterial adhesion filament,Xiang-Qi Mu, http://www.pnas.org/content/103/26/9861.full#corresp-1, consulté le 22/05/2010.
- Architectures and biogenesis of non-flagellar protein appendages in Gram-negative bacteria, The EMBO Journal (2008), Published online: 31 July 2008 : http://www.nature.com/emboj/journal/v27/n17/full/emboj2008155a.htm, consulté le 22/05/2010
- Pilus, http://en.citizendium.org/wiki/Pilus#Type_I_pili, consulté le 22/05/2010.
- Cours sur le sécrétion bactérienne, http://biologie.univ-mrs.fr/upload/p62/TAM1_09.pdf , consulté le 22/05/2010.
- Assembly of Pseudomonas aeruginosa Type IV pil, http://www.sickkids.ca/research/HowellLab/custom/rschPili.asp, consulté le 22/05/2010.
- Anatomie fonctionnelle bacterienne, Stéphane Corvec, Laboratoire de Bactériologie, UFR Medecine Nantes, 2009 , http://www.sante.univ-nantes.fr/med/ticem/ressources/1442.pdf, consulté le 22/05/2010.
- Thèse : G.Jubelin, Formation de biofilms par E.Coli K12 : rôle des systèmes à deux composants dans la synthèse des Curli, Institut national des sciences de Lyon, 2005 consulté le sur http://docinsa.insa-lyon.fr/these/2005/jubelin/these.pdf.