Oxyde de nickel(IV)
L'oxyde de nickel(IV), ou dioxyde de nickel, est un composé chimique ionique de formule NiO2.
| Oxyde de nickel(IV) | |||
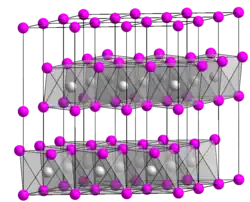 __ Ni4+ __ O2− Maille cristalline de l'oxyde de nickel(IV) |
|||
| Identification | |||
|---|---|---|---|
| Synonymes |
dioxyde de nickel, |
||
| No CAS | |||
| No ECHA | 100.031.645 | ||
| No CE | 234-823-3 | ||
| Apparence | solide cristallisé | ||
| Propriétés chimiques | |||
| Formule | NiO2 | ||
| Masse molaire[1] | 90,692 2 ± 0,001 g/mol Ni 64,72 %, O 35,28 %, |
||
| Précautions | |||
| SGH[2] | |||
  Danger |
|||
| Transport[3] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Préparation
L'oxyde de nickel(IV) peut être obtenu sous forme d'hydrate NiO2·nH2O par oxydation de l'hydroxyde de nickel(II) Ni(OH)2 avec du peroxodisulfate S2O82− en solution aqueuse.
Propriétés physiques et chimiques
Il s'agit d'un solide cristallisé[4] instable, souvent hydraté.
Il cristallise dans une structure déformée en couches, typique de l'iodure de cadmium, de groupe d'espace C2/m, et de paramètres de maille a = 4,875 Å, b = 2,814 Å, c = 5,582 Å, β = 125,8°).
Cet oxyde, ainsi que ses hydrates, sont chimiquement instables, ils se décompose sous l'effet de la chaleur et par simple contact avec l'eau. Ce solide est une matière comburante, un oxydant puissant, activant le feu. Il n'est pas inflammable mais augmente le risque d'incendie lorsqu'il est en contact avec des matières combustibles et est susceptible d'attiser fortement un incendie en cours.
Applications
Il trouve des applications comme oxydant pour convertir des alcools en acides carboxyliques et des hydrazones à chaînes aliphatiques en leur composés diazodialcane correspondant.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) J.M. Tarascon, G. Vaughan, Y. Chabre, L. Seguin, M. Anne, P. Strobel et G. Amatucci, « In Situ Structural and Electrochemical Study of Ni1−xCoxO2 Metastable Oxides Prepared by Soft Chemistry », Journal of Solid State Chemistry, vol. 147, no 1, , p. 410-420 (lire en ligne) DOI 10.1006/jssc.1999.8465
