Nombre quantique magnétique de spin
En mécanique quantique, le nombre quantique magnétique de spin, noté ms, permet de décrire l'état quantique d'une particule ou d'un ensemble de particules de spin non nul. C'est en particulier l'un des quatre nombres quantiques servant à décrire l'état d'un électron dans un atome. Il correspond à la projection du spin de l'électron sur un axe donné, appelé axe de quantification.
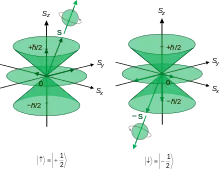
Souvent appelé de manière ambigüe nombre quantique de spin[alpha 1], et parfois nombre magnétique de spin, il peut prendre les valeurs – 12 et + 12, et distingue les deux électrons partageant une même orbitale atomique, généralement représentés par les symboles ↑ (up) et ↓ (down). Le principe de Pauli appliqué à l'atome a pour conséquence que deux électrons d'un même atome ne peuvent avoir leurs quatre nombres quantiques (n, ℓ, mℓ, ms) égaux deux à deux, raison pour laquelle une orbitale atomique donnée, identifiée par les trois nombres quantiques (n, ℓ, mℓ), ne peut contenir plus de deux électrons.
Il a été introduit en 1925, avec la notion de spin, par Wolfgang Pauli afin d'expliquer l'observation de l'effet Zeeman anomal[1]. Classiquement, une sphère chargée en rotation autour d'un de ses axes possède un moment magnétique, d'où la tentative historique d'utiliser ce modèle pour expliquer certaines propriétés magnétiques inattendues de l'électron. Cette interprétation du spin comme une rotation de l'électron sur lui-même a cependant montré certaines limites et a finalement été abandonnée par la suite au profit d'une interprétation purement quantique du spin.
Notes et références
- Le nombre quantique de spin, noté s, est une grandeur intrinsèque des particules élémentaires, distincte du nombre ms ; ce dernier nombre prend toutes les valeurs comprises entre – s et s avec un pas entier, de sorte que, pour l'électron, pour lequel s = 12, on a ms = ± s.
- (de) Wolfgang Pauli, « Über den Einfluß der Geschwindigkeitsabhängigkeit der Elektronenmasse auf den Zeemaneffekt », Zeitschrift für Physik, vol. 31, no 1, , p. 373-385 (DOI 10.1007/BF02980592, Bibcode 1925ZPhy...31..373P, lire en ligne)