Inhibiteur incompétitif
Un inhibiteur incompétitif est un inhibiteur enzymatique qui agit en se liant au complexe enzyme-substrat mais pas à l'enzyme seule. Il bloque la réaction chimique normalement catalysée, de sorte que le complexe enzyme-substrat-inhibiteur ne peut évoluer qu'en redonnant le complexe enzyme-substrat.

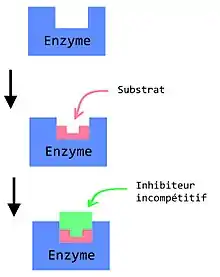
Ce type d'inhibiteur diffère donc d'un inhibiteur compétitif (qui ne peut se lier qu'à une enzyme dont le site actif est libre) ainsi que d'un inhibiteur non compétitif (qui peut se lier aussi bien à l'enzyme dont le site actif est libre qu'au complexe enzyme-substrat)[1].
Mécanisme
Ce type d'inhibition conduit à l'augmentation de l'affinité apparente de l'enzyme pour son substrat car elle réduit la concentration effective du complexe enzyme-substrat. Par conséquent, la constante de Michaelis Km diminue. La vitesse maximum Vmax de la réaction diminue également, car il faut plus de temps pour que les produits de réaction se forment et quittent le site actif de l'enzyme après la formation du complexe enzyme-substrat.
Un inhibiteur incompétitif est d'autant plus efficace que la concentration en substrat est élevée, car il n'agit que sur le complexe enzyme-substrat.

Notes et références
- (en) John Strelow, Walthere Dewe, Phillip Iversen, Harold Brooks, Jeffrey Radding, James McGee et Jeffrey Weidner, « Mechanism of Action Assays for Enzymes », in G. S. Sittampalam, N. P. Coussens, H. Nelson et al. (editeurs), Assay Guidance Manual, Eli Lilly & Company and the National Center for Advancing Translational Sciences, 2004.
- (en) Athel Cornish-Bowden, « simple graphical method for determining the inhibition constants of mixed, uncompetitive and non-competitive inhibitors », Biochemical Journal, vol. 137, no 1, , p. 143-144 (PMID 4206907, PMCID 1166095, lire en ligne)