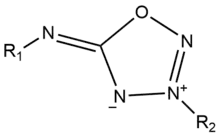
Iminosydnone
Les iminosydnones sont des composés chimiques mésoioniques caractérisés par leurs structures hétérocycliques. Ils sont composés d’un groupe 1,2,3-oxadiazole substitué par un groupement imine contrairement aux sydnones substituées par une cétone[1].
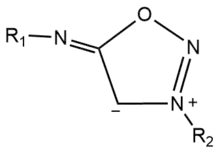
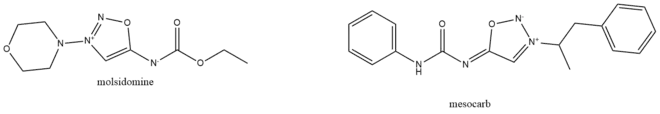
Ils possèdent une charge positive et une charge négative délocalisées sur le cycle et sont pour cette raison des composés dipolaires. Ils ont de nombreuses applications en biologie chimique (chimie bio-orthogonale et chimie click) en tant qu’intermédiaire pour la modification de biomolécules ou de relargage de composés actifs[1]. Ils sont également utilisés comme médicaments tels que le mésocarb ou la molsidomine.
Contexte historique
Les iminosydnones sont des composés assez nouveaux pour la communauté scientifique. Rapportés pour la première fois en 1957 par Brookes[2], les recherches menées sur ces composés avaient pour but d’étudier leurs propriétés biologiques en tant que donneurs de monoxyde d’azote[3]. Dans les années 1970, un iminosydnone - la molsidomine - a été utilisé comme vasodilatateur pour cette propriété[4]. Depuis, les recherches se sont concentrées sur les réactions click-and-release en chimie bio-orthogonale car les iminosydnones possèdent une réactivité particulièrement adaptée aux réactions dans les milieux biologiques.
Synthèse
La synthèse des iminosydnones est une synthèse multi-étapes qui consiste dans un premier temps à former des N-arylamino-acétonitriles grâce à une réaction d’alkylation ou de Strecker. Une aniline correspondante est donc alkylée en présence de chloroacétonitrile et d'iodure de sodium dans la réaction d’alkylation alors que la réaction de Strecker se déroule avec du KCN et du paraformaldéhyde. Ensuite, des nitrosoaminoacétonitriles sont formés avec du nitrite d’isoamyle ou de tert-butyle : cette étape s’appelle la nitrolysation[5]. Enfin, les sels des iminosydnones sont formés lors d’une cyclisation en présence de HCl et de dioxane[6].

Cette voie de synthèse a été la seule décrite jusqu’à présent pour former des sels iminosydnones. Ces derniers sont ensuite capables de réagir avec de puissants électrophiles[7] pour produire des iminosydnones possédant l’amine exocyclique substituée et ainsi décliner cette famille chimique. En condition basique, l’iminosydnone non substitué sur son azote exocyclique n’est pas stable et retourne à son nitrile précurseur. Ces sels peuvent en revanche réagir avec des électrophiles afin de former des produits stables[1].

Réactivité
Stabilité et formes mésomères
Les iminosydnones possèdent différentes structures mésomériques[5]illustrées ci-dessous.
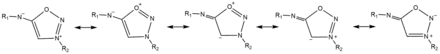
Différence de réactivité entre les sydnones et les iminosydnones
Moins les dipôles mésoioniques sont stabilisés par des effets mésomères, plus ils sont réactifs. La différence de réactivité entre les sydnones et les iminosydnones peut donc s’expliquer par la différence de stabilisation de résonance apportée par leurs différents substituants. L’oxygène exocyclique substituant les sydnones ayant des propriétés stabilisantes plus importantes que l’azote exocyclique substituant les iminosydnones, ces dernières sont moins stabilisées et sont donc plus réactifs que les sydnones classiques[8].
Fonctionnalisation des iminosydnones
L’ajout de fonctions aux iminosydnones sur leur azote exocyclique peut se faire selon deux méthodes différentes, par l’ajout de p-nitrobenzyl carbamate ou d’un sel d’urée imidazolium. L’ajout de ce sel en milieu basique entraîne la formation de carbonylimidazolium-ImSyd qui avec un nucléophile comme une amine ou un alcool permet la fonctionnalisation de l’iminosydnone sur son azote exocyclique.
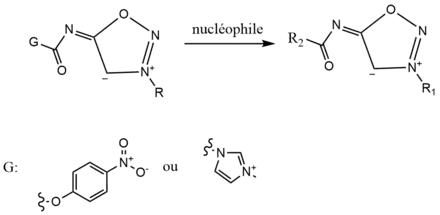
Les autres méthodes permettant d’ajouter des fonctions aux iminosydnones sont similaires à celles pour les sydnones classiques, les iminosydnones possédant également un carbone endocyclique possédant des propriétés nucléophiles[9].
Réactions click-and-release
La réaction SPICC strain-promoted iminosydnone−cycloalkyne cycloaddition se produit via un processus en deux étapes; deux composés d'intérêt sont formés de manière simultanée : un produit click et un produit release. L'iminosydnone réagit d'abord avec le cyclooctyne par une cycloaddition pour former un intermédiaire bicyclique qui subit une réaction rétro-Diels-Alder pour donner un pyrazole (produit click) et un isocyanate d'acyle qui est instantanément converti en l'amide terminal correspondant (produit release), par hydrolyse et décarboxylation[9].
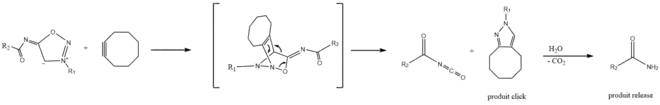
La présence d'une urée ou d'un groupement sulfonamide sur l’azote exocyclique a un effet positif sur la vitesse de réaction, tandis que la présence d'un groupement amide ou carbamate diminue la réactivité de l'iminosydnone[9]. La vitesse de cette réaction augmente en conditions basiques, celles-ci étant plus propices à la présence d’un plus grand nombre de formes mesoioniques. Cela peut constituer une contrainte car certains compartiments cellulaires, tels que les lysosomes, peuvent présenter un pH acide[7].
Le N6-sulfonyl iminosydnone peut être utilisé pour la libération bio-orthogonale de médicaments. Cette stratégie permet de libérer par exemple le célécoxib, un anti-inflammatoire non stéroïdien, par la réaction SPICC click-and-release avec DBCO-COOH[9],ce qui présage pour le futur une possibilité de cibler efficacement l’action de cet anti-inflammatoire avec une efficacité légèrement inférieure à celle du Célécoxib en prise directe[8].
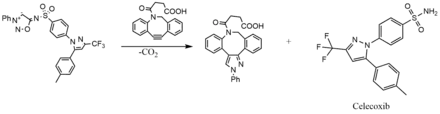
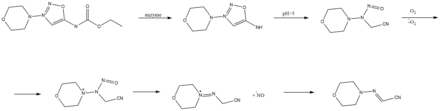
Relargage de monoxyde d’azote par la Molsidomine
Les iminosydnones ont la capacité de relarguer du monoxyde d’azote, une molécule aux propriétés de vasodilatateur. Cette réaction s’effectue par le mécanisme suivant avec, par exemple, la molécule de molsidomine comme réactif[10].
Aza-iminosydnones
La structure des aza-iminosydnones est similaire à celle des iminosydnones classiques, la différence étant le changement d’un de ses carbones cycliques en azote. Ceci influe sur leur utilisation en chimie bioorthogonale, contrairement aux iminosydnones, les azaiminosydnones ne réagissent pas avec les cyclooctynes. Ainsi elles réagissent plutôt dans le cas addition d’alcyne catalysée par le cuivre à l’inverse des sydnones[6].
Applications médicinales
Les propriétés thérapeutiques de l’iminosydnone sont le plus souvent dues à leur rôle en tant qu’agent exogène donneurs de monoxyde d’azote avec pour applications des médicaments contre la tension, l’angine et les thromboses. Ils possèdent également d’autres propriétés biologiques[11] telles que des effets psychostimulants et antibactériens.
La molsidomine[12], utilisé pour son effet anti-angineux et vasodilatateur, ainsi que le mésocarb[13], un traitement développé contre la maladie de Parkinson, sont des composés étudiés pour de telles propriétés.
Le suivi cellulaire des deux composés issues de la réaction SPICC des iminosydnones (pyrazole et la naphtalimide) peut être effectué grâce à leurs propriétés fluorescentes. La réaction bioorthogonale click-and-release permet de libérer ces marqueurs cellulaires fluorophores distincts dans des milieux biologiques et ainsi effectuer leur suivi par une sonde à base d’iminosydnone[5]. Ces nouveaux outils trouvent des applications lors de la libération contrôlée de principes actifs et de leur suivi par fluorescence[14]. La création d’une micelle issue d’une réaction bioorthogonale click-and-release accélérerait la libération du médicaments dans l’organisme[11]. Cette dernière permettrait dans le milieu hydrophile d’une membrane cellulaire, le passage de substances lipophiles. Cela facilite ainsi l’absorption et la diffusion du médicament dans l’organisme et lui permet alors d’atteindre sa cible moléculaire plus rapidement[12].
Notes et références
- (en) Margaux Riomet, Karine Porte, Léa Madegard, Pierre Thuéry, Davide Audisio et Frédéric Taran, « Access to N-Carbonyl Derivatives of Iminosydnones by Carbonylimidazolium Activation », Organic Letters, vol. 22, no 6, , p. 2403–2408 (ISSN 1523-7060, DOI 10.1021/acs.orglett.0c00600)
- Peter Brookes et James Walker, « 889. Formation and properties of sydnone imines, a new class of meso-ionic compound, and some sydnones related to natural α-amino-acids », J. Chem. Soc., no 0, , p. 4409–4416 (DOI 10.1039/JR9570004409)
- M. Feelisch, « The use of nitric oxide donors in pharmacological studies », Naunyn-Schmiedeberg's Archives of Pharmacology, vol. 358, no 1, , p. 113–122 (ISSN 1432-1912, DOI 10.1007/PL00005231)
- M. Hirata et K. Kikuchi, « Coronary collateral vasodilator action of n-ethoxycarbonyl-3-morpholinosydnonimine (sin-10) in heart with chronic coronary insufficiency in dogs », The Japanese Journal of Pharmacology, vol. 20, no 2, , p. 187–193 (DOI 10.1254/jjp.20.187)
- Margaux Riomet, « Les iminosydnones, de nouveaux outils pour la chimie bioorthogonale », HAL, .
- Margaux Riomet, Elodie Decuypere, Karine Porte, Sabrina Bernard, Lucie Plougastel, Sergii Kolodych, Davide Audisio et Frédéric Taran, « Design and Synthesis of Iminosydnones for Fast Click and Release Reactions with Cycloalkynes », Chemistry – A European Journal, vol. 24, no 34, , p. 8535–8541 (DOI https://doi.org/10.1002/chem.201801163)
- Maxime Ribéraud, Karine Porte, Arnaud Chevalier, Léa Madegard, Aurélie Rachet, Agnès Delaunay-Moisan, Florian Vinchon, Pierre Thuéry, Giovanni Chiappetta, Pier Alexandre Champagne, Grégory Pieters, Davide Audisio et Frédéric Taran, « Fast and Bioorthogonal Release of Isocyanates in Living Cells from Iminosydnones and Cycloalkynes », Journal of the American Chemical Society, vol. 145, no 4, , p. 2219–2229 (ISSN 0002-7863, DOI 10.1021/jacs.2c09865).
- Zhuzhou Shao, Wei Liu, Huimin Tao, Fang Liu, Ruxin Zeng, Pier Alexandre Champagne, Yang Cao, K.N. Houk et Yong Liang, « Bioorthogonal release of sulfonamides and mutually orthogonal liberation of two drugs », Chemical communications (Cambridge, England), vol. 54, no 100, , p. 14089–14092 (ISSN 1359-7345, DOI 10.1039/c8cc08533a).
- (en) Karine Porte, Margaux Riomet, Carlotta Figliola, Davide Audisio et Frédéric Taran, « Click and Bio-Orthogonal Reactions with Mesoionic Compounds », Chemical Reviews, vol. 121, no 12, , p. 6718–6743 (ISSN 0009-2665, DOI 10.1021/acs.chemrev.0c00806).
- E. Yu. Khmel’nitskaya, V. I. Levina, L. A. Trukhacheva, N. B. Grigoriev, V. N. Kalinin, I. A. Cherepanov, S. N. Lebedev et V. G. Granik, « Sydnonimines as exogenous NO donors », Russian Chemical Bulletin, vol. 53, no 12, , p. 2840–2844 (ISSN 1573-9171, DOI 10.1007/s11172-005-0199-2).
- CEA, « Chimie « Click and Release » pour la délivrance ciblée de médicaments in vivo » [Actualité:Fait marquant:Résultat scientifique], sur CEA/Institut des sciences du vivant Frédéric Joliot, (consulté le ).
- « Étapes du devenir du médicament » (consulté le )
- (en) Nicolas Pétry, Florian Luttringer, Xavier Bantreil et Frédéric Lamaty, « A mechanochemical approach to the synthesis of sydnones and derivatives », Faraday Discuss., vol. 241, no 0, , p. 114–127 (DOI 10.1039/D2FD00096B).
- Margaux Riomet, Karine Porte, Anne Wijkhuisen, Davide Audisio et Frédéric Taran, « Fluorogenic iminosydnones: bioorthogonal tools for double turn-on click-and-release reactions », Chemical Communications, vol. 56, no 52, , p. 7183–7186 (ISSN 1364-548X, DOI 10.1039/D0CC03067H, lire en ligne, consulté le ).