Hydrogénophosphonate
Les hydrogénophosphonates, souvent nommés H-phosphonates en anglais, sont des composés du phosphore au degré d'oxydation III.
Propriétés générales
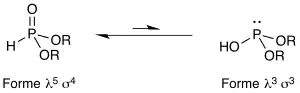
En solution, ces composés existent sous la forme d’un équilibre de deux formes tautomères : une forme pentavalente tétracoordonée (forme phosphonate, soit λ5 σ4) et une forme trivalente tricoordonée (forme phosphite, soit λ3 σ3). La forme phosphonate est ultra-majoritaire dans cet équilibre car l'oxophilie et l'énergie de la liaison P=O sont considérables. Du point de vue de la nomenclature, l'hydrogénophosphonate de diéthyle HP(O)(OEt)2 (forme phosphonate) est équivalent au phosphite de diéthyle HOP(OEt)2 (forme phosphite).
Note : on parle souvent de cette tautomérie en décrivant un équilibre entre PIII et PV, ce qui est une erreur. Il n'y a aucune réaction d'oxydo-réduction dans cet équilibre. L'atome de phosphore reste dans l'état d'oxydation III.
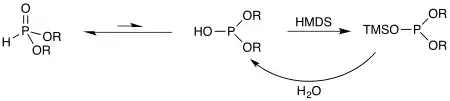
Cependant, l’équilibre peut être déplacé vers la forme phosphite grâce à des agents de silylation comme le HMDS. En effet, le silicium peut se montrer encore plus oxophile que le phosphore et ainsi bloquer un hydrogénophosphonate sous sa forme trivalente. Il ne s'agit plus d'un équilibre, donc on n'obtient que la forme trivalente. Cependant, on peut facilement désilyler ce composé par réaction avec de l'eau.
Voir aussi
- Réaction de Michaelis-Becker