Hexahydrocannabinol
L'hexahydrocannabinol (HHC) est un dérivé hydrogéné du tétrahydrocannabinol.
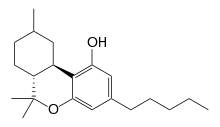
Description
Ce phytocannabinoïde naturel a été identifié comme étant un composant à l'état de trace dans Cannabis sativa[1] - [2], mais qui peut également être reproduit synthétiquement en utilisant la technique de l'hydrogénation des extraits de cannabis[3]. Roger Adams a utilisé le THC naturellement présent dans une plante de Cannabis sativa pour synthétiser du HHC en 1947[4]. Depuis, plusieurs groupes de chercheurs ont synthétisé avec succès du HHC en utilisant du citronellal et de l'olivétol[5], ainsi que d'autres composés apparentés[6]. Le HHC n'a fait l'objet que d'une étude en 2015[7], et en 2020, quand le groupe de chercheurs dirigés par C. de Las Heras a découvert 43 cannabinoïdes en analysant un extrait lipidique de graines de Cannabis sativa, l'un d'eux était l'hexahydrocannabinol (9). Le HHC peut être fabriqué à partir du Δ 8 -THC, du Δ 9 -THC, ou du CBD. L'une des particularités du HHC est qu'il n'y a pas de doubles liaisons dans le cycle cyclohexyle comme avec le D8/D9 THC — elles ont été retirées de la structure et le composé a été hydrogéné[8] - [9]. Il a été démontré que des analogues structuraux similaires au HHC se lient au récepteur endocannabinoïde 1 et produisent des effets chez les animaux, l'énantiomère 9β-HHC étant beaucoup plus actif que le 9α-HHC[10].
Bien qu'il ait été démontré que le HHC se lie au récepteur CB 1, il se lie avec une affinité plus faible que le THC, ce qui indique généralement qu'il n'est pas aussi psychoactif que le THC. Étant donné que le HHC est naturellement présent dans les plants de cannabis, les humains ont probablement consommé sans le savoir des petites quantités de ce cannabinoïde pendant des siècles.
Plusieurs analogues du HHC structurellement apparentés se sont avérés être naturellement présents dans le cannabis, notamment le cannabiripsol[11], le 9α-hydroxyhexahydrocannabinol, le 7-oxo-9α-hydroxyhexa-hydrocannabinol, le 10α-hydroxyhexahydrocannabinol, le 10aR-hydroxyhexahydrocannabinol et le 1′S-hydroxycannabinol[7], 10α-hydroxy-Δ(9,11)-hexahydrocannabinol et 9β,10β-époxyhexahydrocannabinol[12].
Le HHC lui-même a été identifié comme étant un sous-produit de la dégradation du THC, de la même manière que le Cannabinol et le Delta-8-THC peuvent être formés par la plante de cannabis à partir de la dégradation du Delta-9-THC[13] - [14].
Des scientifiques ont découvert que le delta-9-THC se métabolise en 11-hydroxy-THC et en alpha,10 alpha-époxy-hexahydrocannabinol, ainsi qu'en 1,2-époxy-hexahydrocannabinol[15]. Mais aussi que le cannabidiol se métabolise dans l'organisme en 9α-hydroxy-HHC et 8-hydroxy-iso-HHC. En présence d'alcool, des analogues méthoxy ou éthoxy tels que 9-méthoxy-HHC, 10-méthoxy-HHC, 9-éthoxy-HHC et 10-éthoxy-HHC peuvent se former[16].
Interdiction en France
L'ANSM annonce l'interdiction (production, vente et usage) du HHC et deux de ses dérivés, le HHC-acétate (HHCO) et l’hexahydroxycannabiphorol (HHCP) sur le territoire français à partir du 13 juin 2023[17] - [18].
Auparavant ces substances n'entraient pas dans le cadre des législations sur le cannabis tout en présentant pour autant des effets similaires[19].
Composés apparentés
L'hexahydrocannabinol ne doit pas être confondu avec les composés apparentés 9-Nor-9β-hydroxyhexahydrocannabinol (9-Nor-9Beta-HHC) ou 9-Hydroxyhexahydrocannabinol (9-OH-HHC) ou 11-Hydroxyhexahydrocannabinol (11-OH-HHC et 7-OH -HHC), qui ont tous parfois été appelés « HHC ».
- 7,8-Dihydrocannabinol
- 11-Hydroxyhexahydrocannabinol
- Cannabinol
- Delta-6-Cannabidiol
- 9-Nor-9β-hydroxyhexahydrocannabinol
- 9-Hydroxyhexahydrocannabinol
- HU-243
- Canbisol
- Delta-8-THC
- Delta-10-THC
- Tétrahydrocannabiphorol
- THC-O-acétate
Notes et références
- (en) « Phytocannabinoids: a unified critical inventory », Natural Product Reports, vol. 33, no 12, , p. 1357–1392 (PMID 27722705, DOI 10.1039/c6np00074f, S2CID 34267092).
- (en) « GC-MS Metabolite Profile and Identification of Unusual Homologous Cannabinoids in High Potency Cannabis sativa », Planta Medica, vol. 86, no 5, , p. 338–347 (PMID 32053835, DOI 10.1055/a-1110-1045, hdl 2117/188476, S2CID 211113472).
- Brevet US 9694040 Hydrogenation of cannabis oil, délivré le 10 novembre 2016 à Research Grow.
- Brevet US 2419937 Marihuana active compounds, délivré le 6 mai 1947 à Roger Adams.
- (en) « Efficient one-pot synthetic approaches for cannabinoid analogues and their application to biologically interesting (-)-hexahydrocannabinol and (+)-hexahydrocannabinol », Tetrahedron Letters, vol. 49, , p. 3283 (DOI 10.1016/j.tetlet.2008.03.075).
- (en) « Enantioselective Total Synthesis of Potent 9β-11-Hydroxyhexahydrocannabinol », The Journal of Organic Chemistry, vol. 85, no 2, , p. 1291–1297 (PMID 31833372, DOI 10.1021/acs.joc.9b02962, S2CID 209343301).
- (en) « Minor oxygenated cannabinoids from high potency Cannabis sativa L », Phytochemistry, vol. 117, , p. 194–199 (PMID 26093324, PMCID 4883105, DOI 10.1016/j.phytochem.2015.04.007).
- (en) « In vitro metabolism of the equatorial C11-methyl isomer of hexahydrocannabinol in several mammalian species », Drug Metabolism and Disposition, vol. 19, no 3, , p. 714–716 (PMID 1680642, lire en ligne)
- (en) « Comparative in vitro metabolism of the cannabinoids », Pharmacology, Biochemistry, and Behavior, vol. 40, no 3, , p. 533–540 (PMID 1806943, DOI 10.1016/0091-3057(91)90359-a, S2CID 25827210).
- (en) « The importance of the orientation of the C9 substituent to cannabinoid activity », Journal of Medicinal Chemistry, vol. 32, no 7, , p. 1630–1635 (PMID 2738895, DOI 10.1021/jm00127a038).
- (en) « Cannabiripsol: a novel Cannabis constituent », Experientia, vol. 35, no 10, , p. 1278–1279 (PMID 499397, DOI 10.1007/BF01963954, S2CID 19529732)
- (en) « Isolation and Pharmacological Evaluation of Minor Cannabinoids from High-Potency Cannabis sativa », Journal of Natural Products, vol. 78, no 6, , p. 1271–1276 (PMID 26000707, PMCID 4880513, DOI 10.1021/acs.jnatprod.5b00065).
- (en) « Constituents of Cannabis sativa L. IV. Stability of cannabinoids in stored plant material », Journal of Pharmaceutical Sciences, vol. 62, no 10, , p. 1601–1605 (PMID 4752104, DOI 10.1002/jps.2600621005)
- (en) « Stability of tetrahydrocannabinols II », Journal of Pharmaceutical Sciences, vol. 67, no 1, , p. 27–32 (PMID 22740, DOI 10.1002/jps.2600670108).
- (en) « Cytochrome P-450 isozymes involved in the oxidative metabolism of delta 9-tetrahydrocannabinol by liver microsomes of adult female rats », Drug Metabolism and Disposition, vol. 20, no 1, , p. 79–83 (PMID 1347001, lire en ligne).
- (en) « Conversion of Cannabidiol (CBD) into Psychotropic Cannabinoids Including Tetrahydrocannabinol (THC): A Controversy in the Scientific Literature », Toxics, vol. 8, no 2, , p. 41 (PMID 32503116, PMCID 7357058, DOI 10.3390/toxics8020041).
- « Actualité - L’ANSM classe l’hexahydrocannabinol (HHC) et deux de ses dérivés sur la liste des stupéfiants », sur ANSM (consulté le )
- « Cannabis : le HHC sera interdit en France à partir de mardi », Le Monde.fr, (lire en ligne, consulté le )
- « Le HHC, nouveau cannabis de synthèse en vente libre, suscite l’inquiétude », Le Monde.fr, (lire en ligne, consulté le )