Graphe de Gran
Un graphe de Gran (aussi méthode de Gran et titrage de Gran) est un moyen usuel d'étalonner un titrate ou un titrant en estimant le volume d'équivalence pendant un titrage d'un acide fort avec une base forte ou pendant un titrage potentiométrique. De tels graphes peuvent aussi servir à estimer le contenu en carbonate d'une solution aqueuse, ainsi que les constantes d'acidité Ka d'acides ou bases faibles à partir de données de titrage.
Les graphes de Gran mettent en œuvre des approximations linéaires de relations a priori non-linéaires entre la quantité mesurée, le pH ou le potentiel électromoteur (f.e.m.), et le volume de titrant ajouté. D'autres types de mesures de concentration, tels que l'absorbance spectrophotométrique ou les déplacements chimiques en RMN, peuvent en principe aussi servir. Ces approximations ne sont valides que près du point d'équivalence, mais non pas au point d'équivalence, et donc la méthode diffère des autres estimations de point d'équivalence utilisant les premiers ou seconds dérivés, méthodes qui requièrent des données au point d'équivalence. À l'origine, c'est-à-dire avant l'arrivée d'ordinateurs, les graphes de Gran ont été conçus comme détermination graphique, où un tracé sur papier quadrillé serait manuellement extrapolé pour estimer l'intersection sur l'abscisse (l'axe du volume). Ce procédé a été depuis remplacé par l'analyse plus précise par la méthode des moindres carrés, surtout à l'aide de logiciels de feuilles de calcul qui possèdent une fonction intégrée appliquant la méthode des moindres carrées.
Titrage d'acide fort par base forte
Lors d'un titrage pH-métrique d'une solution d'acide fort, nous avons à chaque ième point,
où Kw est la constante de autoprotolyse de l'eau.
Si le volume de départ de l'acide est et sa concentration , et si le titrage utilise une base de concentration , à tout ième point pendant le titrage avec un volume cumulé de titrant ,
Au point d'équivalence, le volume d'équivalence .
Or,
| un graphe de | vs. | aura une région linéaire | avant | l'équivalence, avec pente |
| et un graphe de | vs. | aura une région linéaire | après | l'équivalence, avec pente |
| les deux graphes auront | comme intersection de l'abscisse |
Le volume d'équivalence est utilisé pour calculer l'inconnu, soit ou .
Avant d'entamer le titrage, le pH-mètre est d'habitude calibré à l'aide de solutions tampons aux pH connus. La puissance ionique peut être maintenue par un choix judicieux de l'acide et de la base. Par exemple, un titrage de l'acide HCl avec la base NaOH d'à-peu-près la même concentration remplacera H+ par un ion de même charge (Na+) à plus ou moins la même concentration, pour maintenir la puissance ionique assez constante. Autrement, on peut utiliser une concentration relativement élevée d'électrolyte de fond, ou le coefficient d'activité peut être calculé[1].
Titrage de base forte par acide fort
Des graphes illustrants les précédents sont obtenus avec un titrage de base forte par acide fort, et les pentes sont inversées.
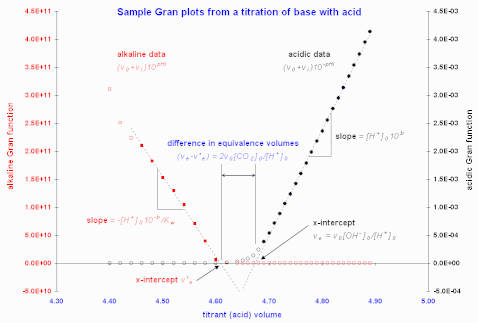
Figure 1. graphes de Gran illustratifs à partir des données de Butler (1998). Les cercles emplis indiquent les points retenus pour le calcul de l'intersection par la méthode des moindres carrées donnant les courbes pointillées.
Donc,
vs. aura une région linéaire avant l'équivalence
avec pente
et vs. aura une région linéaire après l'équivalence
avec pente
les deux graphes auront comme intersection de l'abscisse
La Figure 1 présente des graphes de Gran à la suite d'un titrage d'une base forte par un acide fort.
Concentrations et constantes de dissociation d'acides faibles
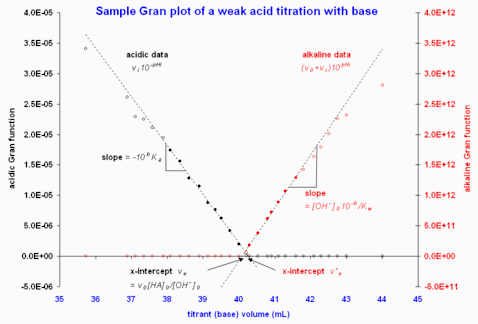
Figure 2. graphes de Gran illustratifs à partir des données d'« une source en ligne » (consulté le ) Seule la région près de l'équivalence est présentée, puisque les données loin du point d'équivalence devient fortement de la linéarité. Les cercles emplis indiquent les points retenus pour le calcul de l'intersection par la méthode des moindres carrées donnant les courbes pointillées.
La méthode peut estimer les constantes de dissociation d'acides faibles, ainsi que leurs concentrations (Gran, 1952). Si l'acide est représenté par HA, où
- ,
on aura à chaque ième point d'un titrage d'un volume d'un acide à concentration par une base à concentration dans la région linéaire loin d'équivalence
- et
qui sont des approximations valides, d'où
- , ou
- ou, parce que ,
- .
Un graphe de contre aura comme pente sur la région acide linéaire, et une intersection avec l'abscisse , duquel soit ou peut être calculé[1]. La région alcaline est traitée de la même manière que pour une titrage d'un acide fort par une base forte. La Figure 2 donne un exemple; ici, les deux intersections diffèrent d'à-peu-près 0,2 mL, mais ceci n'est qu'un petit écart (0,5 %), vu le gros volume d'équivalence.
Des équations semblables peuvent être dérivées pour un titrage d'une base faible par un acide fort. (Gran, 1952; Harris, 1998).
Contenu en carbonate
Martell et Motekaitis (1992) ont utilisé les régions les plus linéaires pour leurs graphes, puis exploité la différence entre le volume d'équivalence mesuré du côté acide et celui mesuré du côté alcalin pour ainsi estimer la quantité de CO2 absorbée par la solution alcaline. Ce processus est illustré dans la Figure 1. Dans ce cas, l'acide supplémentaire qui sert à neutraliser le carbonate, par double protonation, dans un volume de titrate est . Dans le cas contraire d'un titrage d'acide par de la base, la teneur en carbonate est calculée de façon similaire avec , où cette fois représente le volume d'équivalence mesuré du côté alcalin (d'après Martell et Motekaitis).
Quand le contenu total de CO2 absorbé est important, tel que dans les eaux naturelles et les effluents alcalins, deux ou trois inflections peuvent être décelées dans la courbe pH-volume dues aux effets tampons qu'ont le bicarbonate et le carbonate en concentrations importantes. Comme l'ont discuté Stumm et Morgan (1981), l'analyse de telles eaux peut mettre en œuvre jusqu'à six graphes de Gran à partir d'une seule titrage pour estimer les multiples points d'équivalence et mesurer l'alcalinité totale et les concentrations de carbonate et/ou de bicarbonate.
Contrôle potentiométrique de H+
Pour utiliser des mesures potentiométriques au lieu de pour contrôler la concentration de , on peut de façon triviale laisser et appliquer les équations ci-dessus, où est la correction du décalage de la réponse potentiométrique et est une correction de la pente de la réponse potentiométrique (1/59.2 unités de pH/mV à 25 °C), de sorte que remplace .
Ainsi, comme vu plus tôt pour un titrage d'acide fort par une base forte,
vs. aura une région linéaire avant l'équivalence, avec pente
vs. aura une région linéaire après l'équivalence, avec pente
les deux auront comme intersection sur x et, comme auparavant, le volume d'équivalence provenant du côté acide servira à étalonner la concentration inconnue, et la différence entre les deux volumes d'équivalence servira à estimer la teneur en carbonate
Des graphiques analogues peuvent être construits avec les données d'un titrage d'une base par de l'acide.
Calibrage d'électrode
L'analyse de données potentiométriques nécessite la connaissance préalable de et de .
Si l'électrode est mal calibré, une correction de décalage peut être calculée in situ à partir de la pente en milieu acide:
- Pour un titrage d'un acide par de la base, la pente du côté acide est , d'où peut être calculé à l'aide de la valeur connue de ou celle provenant du volume d'équivalence. peut ensuite être calculé à partir de la pente du côté alcalin.
- Pour un titrage d'une base par de l'acide, telle qu'illustré dans les exemples, la pente du côté acide, , sert pareillement à calculer , et la pente du côté alcalin, sert à calculer . Dans l'exemple de la Figure 1, le décalage n'était pas conséquent, car s'est avéré être -0.054 unités de pH.
La valeur de , par contre, peut dévier de la valeur théorique et ne peut être évaluée que par le calibrage de l'électrode. Ceci est souvent effectué avec des solutions tampons aux pH connus, ou en titrant un acide fort avec une base forte, dans lequel cas une force ionique constante peut être maintenue, et sera connu à tous les points du titrage si et sont tous deux connus (et qui devraient être directement reliés à des étalons primaires). Par exemple, Martell et Motekaitis (1992) ont calculé le pH prévu au début du titrage, ayant au préalable titré les solutions d'acide et de base contre des étalons primaires, puis ajusté le pH ainsi relevé, mais ceci ne donne pas de correction de la pente si l'une est nécessaire.
Suivant le travail antérieur de McBryde (1969), Gans et O'Sullivan (2000) décrivent une approche itérative pour calculer et dans la relation , à partir d'un titrage d'acide fort avec une base forte:
- est d'abord estimé à l'aide des données acides selon Rossotti et Rossotti (1965), et est en premier lieu donné sa valeur théorique;
- on trace des fonctions Gran modifiées, soit vs. du côté acide de l'équivalence et vs. du côté alcalin, et les volumes d'équivalence et en sont calculés, comme auparavant;
- comme auparavant, la différence entre ces volumes d'équivalence servent à estimer le contenu en carbonate mais aussi pour calculer une 'concentration effective' de la base du côté alcalin de l'équivalence;
- les valeurs approximatives de sont calculées avec du côté acide et avec du côté alcalin;
- la définition est réécrite , et les données de potentiel sont tracées contre , en utilisant les valeurs de qui correspondent aux valeurs de pH entre 2.5 et 4.5, et entre 10.7 et 11.5[2]; la méthode linéaire des moindres carrés procure alors la pente et l'intersection ;
- les étapes 2 et 3 sont répétées avec les nouvelles valeurs de et pour atteindre une plus grande précision dans le calcul des volumes d'équivalence et du contenu en CO2.
Cette procédure pourrait en principe être modifiée pour des titrages de base par de l'acide. Le logiciel GLEE (nom dérivé de 'GLass Electrode Evaluation') met en œuvre cette approche pour étalonnage d'un électrode à partir d'un titrage d'acide fort par une base forte. Ce logiciel peut aussi calculer (par un procédé non-linéaire de moindres carrés séparé) une « correction » de la concentration de la base. L'avantage de cette méthode est que le calibrage peut être conduit dans le même milieu à force ionique constante que l'on utilisera pour la détermination des constantes d'équilibre.
Il est à noter que les fonctions de Gran habituelles donnent aussi les volumes d'équivalence requis et que, comme porte au départ sa valeur théorique, la valeur estimée de à la première étape aurait pu provenir de la pente du côté acide, tel que détaillé plus tôt. Aussi, ce procédé calcule la teneur en CO2 et peut donc être combiné avec un étalonnage complet de la base, en utilisant la définition de pour obtenir . Finalement, la plage de pH utilisée pourrait être étendue en trouvant par la quadratique .
Contrôle potentiométrique d'autres espèces
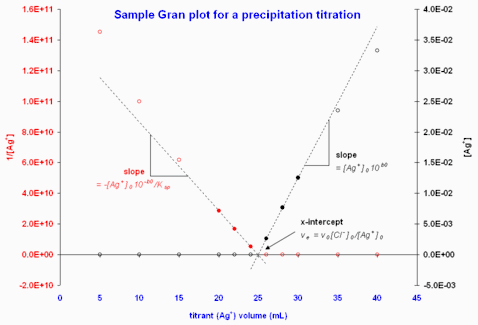
Figure 3. graphes de Gran illustratifs à partir des données d'un titrage de Cl− par Ag+ avec contrôle potentiométrique. Les potentiels ont été converties en valeurs de [Ag+]. Les cercles emplis indiquent les points retenus pour le calcul de l'intersection par la méthode des moindres carrées donnant les courbes pointillées.
Lorsque l'on contrôle une autre espèce, disons , par la potentiométrie, on peut appliquer le même formalisme avec . Alors, un titrage d'une solution d'une seconde espèce par devient analogue à un titrage d'une base par de l'acide avec contrôle du pH, d'où un graphe soit de ou de contre aura un intersection sur x de . Dans un titrage contraire de par , le volume d'équivalence sera . La signification des pentes dépendra alors du type d'interaction entre les deux espèces, qu'il s'agisse d'une association ou d'une précipitation (Gran, 1952), mais, d'habitude, le seul résultat désiré est le point d'équivalence. Toutefois, la pente qui précède le point d'équivalence peut en principe servir à mesurer le produit de solubilité de la même façon que l'on évalue le avec un titrage acide-base, bien que d'autres interactions entre paires d'ions peuvent aussi opérer[3].
Pour illustrer ceci, prenons l'exemple d'un titrage potentiométrique de Cl− par Ag+:
Donc,
vs. aura une région linéaire avant l'équivalence, avec pente
et vs. aura une région linéaire après l'équivalence, avec pente
dans les deux cas, l'intersection avec x sera
La figure 3 donne un exemple de données potentiométriques d'un tel titrage.
Comportement non-idéal
Dans tout titrage sans espèces tampons, les graphes avant et après l'équivalence devraient idéalement croiser l'abscisse au même point, mais un comportement non-idéal peut être occasionné par des erreurs de mesures (e.g. avec un électrode mal calibré, un temps d'équilibration insuffisant avant d'enregistrer le potentiel, une dérive de la force ionique), des erreurs d'échantillonnage (e.g. une densité de données faible dans les régions linéaires) ou par un modèle chimique incomplet (e.g. avec la présence d'impuretés titrables telle que le carbonate dans la base, ou une précipitation incomplète lors d'un titrage potentiométrique à cause de solutions trop diluées, pour lequel cas Gran et al. (1981) propose des approches alternatives). Buffle et al. (1972) discutent de plusieurs sources de telles erreurs.
Parce que les fonctions en ou de Gran ne tendent qu'asymptotiquement vers zéro, sans jamais l'atteindre, la courbure qui résulte en approche de l'équivalence est attendue dans tous les cas. Toutefois, les praticiens ne s'accordent pas sur quelles données utiliser pour déterminer l'équivalence, qu'il s'agisse d'utiliser les données avant ou après l'équivalence ou des deux côtés, et qu'il s'agisse d'inclure les données les plus proches de l'équivalence ou seulement celles dans les portions les plus linéaires[4] - [5]: Les données les plus proches de l'équivalence feront en sorte que les deux estimations de l'intersection sur l'axe de x seront plus coïncidants et coïncideront mieux aussi aux estimés provenant des premiers ou seconds dérivés, alors que l'on peut présumer que les données à pH acide seront moins assujetties aux interférences provenant d'impuretés tamponneuses et titrables, telles que le bicarbonate et le carbonate dans la base (voir Contenu en carbonate), ainsi que de l'effet d'une force ionique dérivante. Dans les graphiques donnés ici en exemples, les régions les plus linéaires (les données représentées par les cercles emplis) étaient celles choisies pour le traitement par la méthode des moindres carrés donnant les pentes et intersections. La sélection des données à retenir est toujours subjective.
Littérature citée
- Buffle, J., Parthasarathy, N. et Monnier, D. (1972): Errors in the Gran addition method. Part I. Theoretical Calculation of Statistical Errors; Anal. Chim. Acta 59, 427-438; Buffle, J. (1972): Anal. Chim. Acta 59, 439.
- Butler, J. N. (1991): Carbon Dioxide Equilibria and Their Applications; CRC Press: Boca Raton, FL.
- Butler, J. N. (1998): Ionic Equilibrium: Solubility and pH Calculations; Wiley-Interscience. Chap. 3.
- Gans, P. et O'Sullivan, B. (2000): GLEE, a new computer program for glass electrode calibration; Talanta, 51, 33–37.
- Gran, G. (1950): Determination of the equivalence point in potentiometric titrages, Acta Chem. Scand., 4, 559-577.
- Gran, G. (1952): Determination of the equivalence point in potentiometric titrages-- Part II, Analyst, 77, 661-671.
- Gran, G., Johansson, A. et Johansson, S. (1981): Automatic titrage by Stepwise Addition of Equal Volumes of Titrant Part VII. Potentiometric Precipitation titrages, Analyst, 106, 1109-1118.
- Harris, D. C.: Quantitative Chemical Analysis, 5th Ed.; W.H. Freeman & Co., New. York, NY, 1998.
- Martell, A. E. et Motekaitis, R. J.: The determination and use of stability constants, Wiley-VCH, 1992.
- McBryde, W. A. E. (1969): Analyst, 94, 337.
- Rossotti, F. J. C. et Rossotti, H. (1965): J. Chem. Ed., 42, 375
- Skoog, D. A., West, D. M., Holler, F. J. et Crouch, S. R. (2003): Fundamentals of Analytical Chemistry: An Introduction, 8th Ed., Brooks and Cole, Chap. 37.
- Stumm, W. et Morgan, J. J. (1981): Aquatic chemistry, 2nd Ed.; John Wiley & Sons, New York.
Notes
- Si la force ionique n'est pas constante, on peut modifier cette expression pour un quotient d'activité changeant. Voir Harris (1998) ou ce « document en ligne » (consulté le )
- Pour un électrode de verre, ces plages de pH sont les régions de linéarité qui évitent la variation des potentiels de jonction et/ou l'erreur alcaline aux extrêmes de pH, et qui de surcroît évitent les erreurs de mesure près de l'équivalence ainsi que les erreurs de calcul dues aux mises à l'écart de du côté acide et de l'équilibre carbonate/bicarbonate du côté alcalin.
- Gran et al. (1981) traite plus longuement de ce sujet, tenant compte des autres espèces complexes générées dans les titrages de Cl− par Ag+ (Ag2Cl+ et AgCl2−, notamment), ainsi que dans d'autres titrages avec précipitation, pour calculer les volumes d'équivalence quand les concentrations sont faibles et la précipitation incomplète.
- Les instructions fournies aux étudiants témoignent des différentes pratiques recommandées. Par exemple, C. Chambers de l'université George Fox recommande d'utiliser les données du côté acide "juste avant" le point d'équivalence dans les titrages acide-base (« document en ligne » (consulté le )). Suivant Harris (1998), M. El-Koueidi et M. Murphy de l'université de la Caroline du Nord à Charlotte (« document en ligne » (consulté le )) et W. Wolbach de l'université Depaul (« document en ligne » (consulté le )) recommandent l'utilisation des derniers 10-20 % des données précédant l'équivalence, et Wolbach reconnaît que les données du côté alcalin peuvent aussi servir à mesurer le contenu en CO2 de la base. De manière semblable, W. E. Brewer et J. L. Ferry de l'université de la Caroline du Sud recommandent d'utiliser les données devançant de 10 % l'équivalence (« document en ligne » (consulté le )). K. Kuwata de l'université Macalester College recommande à ses étudiants de choisir la quelconque portion de données avant l'équivalence qui donne la ligne la plus droite(« document en ligne » (consulté le )). D. L. Zellmer de l'université California State à Fresno demande aux étudiants d'utiliser les données de part et d'autre de l'équivalence, mais celles les plus éloignées du point d'équivalence, et d'évaluer les erreurs pour ainsi déterminer si les deux estimations du volume d'équivalence diffèrent de façon importante (données pH: « document en ligne » (consulté le ); titrage potentiométrique de chlorure par l'ion d'argent: « document en ligne » (consulté le )).
- Butler (1991) discute du problème de la sélection de données, et examine aussi les interférences provenant d'impuretés comme le borate et le phosphate.
![{\displaystyle K_{w^{}}=[H^{+}]_{i}[OH^{-}]_{i}}](https://img.franco.wiki/i/1db0b94c20344944dea92ee4878afb135017aaef.svg)

![{\displaystyle [H^{+}]_{0^{}}}](https://img.franco.wiki/i/1ad86c50bb5c87cbc6ce8e6140089390b1797c64.svg)
![{\displaystyle [OH^{-}]_{0^{}}}](https://img.franco.wiki/i/349ebe8d364545dc81a278f8396263ae21b7c12b.svg)

![{\displaystyle {\frac {v_{0}[H^{+}]_{0}-v_{i}[OH^{-}]_{0}}{v_{0}+v_{i}}}{\begin{cases}\approx [H^{+}]_{i}{\text{ ou }}10^{-pH_{i}}&{\text{ si }}v_{0^{}}[H^{+}]_{0}>v_{i}[OH^{-}]_{0}\mathrm {~(r{\acute {e}}gion~acide)} \\=0&{\text{ si }}v_{0^{}}[H^{+}]_{0}=v_{i}[OH^{-}]_{0}\mathrm {~(point~d'{\acute {e}}quivalence)} \\\approx -[OH^{-}]_{i}{\text{ ou }}-K_{w}10^{pH_{i}}&{\text{ si }}v_{0^{}}[H^{+}]_{0}<v_{i}[OH^{-}]_{0}\mathrm {~(r{\acute {e}}gion~alcaline)} \end{cases}}}](https://img.franco.wiki/i/4e6bf6eef1301b61e27021b24880d95099cfa942.svg)



![{\displaystyle -[OH^{-}]_{0^{}}}](https://img.franco.wiki/i/30990190f192ab893969327d787e617348fe2441.svg)

![{\displaystyle [OH^{-}]_{0}/K_{w^{}}}](https://img.franco.wiki/i/af930d58632586406096e06ab513b848df232ae7.svg)
![{\displaystyle v_{e}=v_{0}[H^{+}]_{0}/[OH^{-}]_{0^{}}}](https://img.franco.wiki/i/f5699e3929db80c1d0387b0fa7ec845a08cc88c9.svg)

![{\displaystyle {\frac {v_{0}[OH^{-}]_{0}-v_{i}[H^{+}]_{0}}{v_{0}+v_{i}}}{\begin{cases}\approx [OH^{-}]_{i}{\text{ ou }}K_{w}10^{pH_{i}}&{\text{ si }}v_{0^{}}[OH^{-}]_{0}>v_{i}[H^{+}]_{0}\mathrm {~(r{\acute {e}}gion~alcaline)} \\=0&{\text{ si }}v_{0^{}}[OH^{-}]_{0}=v_{i}[H^{+}]_{0}\mathrm {~(point~d'{\acute {e}}quivalence)} \\\approx -[H^{+}]_{i}{\text{ ou }}-10^{-pH_{i}}&{\text{ si }}v_{0^{}}[OH^{-}]_{0}<v_{i}[H^{+}]_{0}\mathrm {~(r{\acute {e}}gion~acide)} \end{cases}}}](https://img.franco.wiki/i/627bb36a5086a00d46d6e620e004e8787368769d.svg)
![{\displaystyle -[H^{+}]_{0}/K_{w^{}}}](https://img.franco.wiki/i/6fddfd232316e598f2b66875c068bc44460cdd77.svg)
![{\displaystyle v_{e}=v_{0}[OH^{-}]_{0^{}}/[H^{+}]_{0}}](https://img.franco.wiki/i/c6704c0ce6a65dc0dd1076e376c07a25074b0c56.svg)
![{\displaystyle K_{a}={\frac {[H^{+}]_{i}[A^{-}]_{i}}{[HA]_{i}}}}](https://img.franco.wiki/i/cdf8a34c0247b6b88619d4d2668221637a258b99.svg)

![{\displaystyle [HA]_{0}}](https://img.franco.wiki/i/1756ca0b12a2f09e9ace6fefaf7667454ed186d2.svg)
![{\displaystyle [OH^{-}]_{0}}](https://img.franco.wiki/i/528d40dd3e1f5de41850626c0b99d0a7f538f8ae.svg)
![{\displaystyle [HA]_{i}\approx {\frac {v_{0}[HA]_{0}-v_{i}[OH^{-}]_{0}}{v_{0}+v_{i}}}}](https://img.franco.wiki/i/19224a237e91bfe16ce79a2973ddb89dbba5f4c2.svg)
![{\displaystyle [A^{-}]_{i}\approx {\frac {v_{i}[OH^{-}]_{0}}{v_{0}+v_{i}}}}](https://img.franco.wiki/i/f8ac0f9648acacf896ef1e36fb107d1eb9f6c4c2.svg)
![{\displaystyle K_{a}\approx {\frac {10^{-pH_{i}}v_{i}[OH^{-}]_{0}}{v_{0}[HA]_{0}-v_{i}[OH^{-}]_{0}}}}](https://img.franco.wiki/i/d9bc507e795dfea831b4012a9dcf742c91beed1c.svg)
![{\displaystyle K_{a}(v_{0}{\frac {[HA]_{0}}{[OH^{-}]_{0}}}-v_{i})\approx 10^{-pH_{i}}v_{i}}](https://img.franco.wiki/i/77dc2909198804c04da9d24a259197c9d439d359.svg)
![{\displaystyle v_{e}=v_{0}{\frac {[HA]_{0}}{[OH^{-}]_{0}}}}](https://img.franco.wiki/i/a195a786d0c9400c36d1e1eaff9ddebfd7cb8c9e.svg)




![{\displaystyle [HA]_{0^{}}}](https://img.franco.wiki/i/01055bdd1d78a237b8c0bf09dd10fc8457520cdb.svg)
![{\displaystyle (v_{e}-v_{e}^{\prime })[H^{+}]_{0^{}}=2v_{0}[CO_{2}]_{0}}](https://img.franco.wiki/i/cd551caef6ac3c109713851f5b6345c2fcaffeb2.svg)
![{\displaystyle (v_{e}^{\prime }-v_{e})[OH^{-}]_{0^{}}=2v_{e}^{\prime }[CO_{2}]_{0}}](https://img.franco.wiki/i/cb1956588a4c55722d610e836490ea8ea159e414.svg)




![{\displaystyle -log_{10}[H^{+}]_{i}=b_{0}-b_{1}E_{i^{}}}](https://img.franco.wiki/i/70741e6ba1b626302187955e8b1d32ce102eba20.svg)






![{\displaystyle -10^{b_{0}}[OH^{-}]_{0^{}}}](https://img.franco.wiki/i/d8a85a80049e3f6c5297bbf42f8deccbce01821c.svg)

![{\displaystyle 10^{-b_{0}}[OH^{-}]_{0}/K_{w^{}}}](https://img.franco.wiki/i/86b814278e54ca0355316067e831e769e5519e08.svg)
![{\displaystyle -[OH^{-}]_{0^{}}10^{b}}](https://img.franco.wiki/i/cd15d2aa4349c85b71c5bff531246530cc4b5faa.svg)


![{\displaystyle [H^{+}]_{0^{}}10^{b}}](https://img.franco.wiki/i/47eedeb2d66a9b0551ede137b38dcf4092234c4e.svg)
![{\displaystyle -[H^{+}]_{0^{}}10^{-b_{0}}/K_{w}}](https://img.franco.wiki/i/0ead3ce9876a94a8bd46d7cfe73e707bc2e7707a.svg)
![{\displaystyle [H^{+_{}}]_{i}}](https://img.franco.wiki/i/becbf5d2e21654200c46fa31d0f2c3145403f992.svg)
![{\displaystyle [H_{}^{+}]_{0}}](https://img.franco.wiki/i/39338d2723e07adaecc434ec8d7e86fa6499f239.svg)
![{\displaystyle [OH_{}^{-}]_{0}}](https://img.franco.wiki/i/650afe4f973213f6c9c51c2c92009f87a08a4372.svg)


![{\displaystyle v_{e}[OH^{-}]_{0^{}}/v_{e}^{\prime }}](https://img.franco.wiki/i/b5a35c98ffe984a3ac4995bf249effd05b1fed3e.svg)
![{\displaystyle [H^{+}]_{i^{}}}](https://img.franco.wiki/i/bcac7a06f0f699d71340713329cd33e33c623abb.svg)
![{\displaystyle (v_{0^{}}[H^{+}]_{0}-v_{i}[OH^{-}]_{0})/(v_{0}+v_{i})}](https://img.franco.wiki/i/4dc107a833fc669533394df6901c516255bd6e46.svg)
![{\displaystyle (v_{e}[H^{+}]_{0}-v_{i}v_{e}[OH^{-}]_{0}/v_{e}^{\prime })/(v_{0}+v_{i})}](https://img.franco.wiki/i/721aaf6302494a767750d0c7c4f176e14345f69e.svg)
![{\displaystyle E_{i^{}}=b_{0}/b_{1}+(1/b_{1})log_{10}[H^{+}]_{i}}](https://img.franco.wiki/i/81d60b752e3a97207ac1564c74b77021bb2b8748.svg)
![{\displaystyle log_{10}[H^{+}]_{i^{}}}](https://img.franco.wiki/i/aa262e87a4d416162b2e3ce1d9c18980afb6f1f8.svg)


![{\displaystyle (v_{0{^{}}}[H^{+}]_{0}-v_{i}[OH^{-}]_{0})/(v_{0}+v_{i})=[H^{+}]_{i}-K_{w}/[H^{+}]_{i}}](https://img.franco.wiki/i/0bb66cda334f6082deb14053a64f5dd26e3375ae.svg)

![{\displaystyle -log_{10}[S^{1}]_{i}=b_{0}-b_{1}E_{i^{}}}](https://img.franco.wiki/i/bdcdb2dbf4bb1e3adae9a8d420ee793d276f39b7.svg)

![{\displaystyle v_{0}[S^{0}]_{0}/[S^{1}]_{0^{}}}](https://img.franco.wiki/i/c7cb445111bc6469dc5c85492d9997f48d3ca1c9.svg)
![{\displaystyle v_{0}[S^{1}]_{0}/[S^{0}]_{0^{}}}](https://img.franco.wiki/i/8795d1a16a8e7bad358482bacee448b6cfd1f5c0.svg)

![{\displaystyle {\frac {v_{0}[Cl^{-}]_{0}-v_{i}[Ag^{+}]_{0}}{v_{0}+v_{i}}}{\begin{cases}\approx [Cl^{-}]_{i}{\text{ ou }}K_{sp}10^{-b_{1}E_{i}+b_{0}}&{\text{ lorsque }}v_{0^{}}[Cl^{-}]_{0}>v_{i}[Ag^{+}]_{0}\mathrm {~(avant~l'{\acute {e}}quivalence)} \\=0&{\text{ lorsque }}v_{0^{}}[Cl^{-}]_{0}=v_{i}[Ag^{+}]_{0}\mathrm {~({\grave {a}}~l'{\acute {e}}quivalence)} \\\approx -[Ag^{+}]_{i}{\text{ ou }}-10^{b_{1}E_{i}-b_{0}}&{\text{ lorsque }}v_{0^{}}[Cl^{-}]_{0}<v_{i}[Ag^{+}]_{0}\mathrm {~(apr{\grave {e}}s~l'{\acute {e}}quivalence)} \end{cases}}}](https://img.franco.wiki/i/3bd9751453a5b5accada7c7e0f2add6af1e5959f.svg)
![{\displaystyle -[Ag^{+}]_{0}10^{-b_{0}}/K_{sp^{}}}](https://img.franco.wiki/i/9b9c5abe2ea483461e18a92ca2d2da8f1f748219.svg)
![{\displaystyle [Ag^{+}]_{0^{}}10^{b_{0}}}](https://img.franco.wiki/i/7b562cbcbc203994c58df2cd1d371fe06f3ed78b.svg)
![{\displaystyle v_{e}=v_{0}[Cl^{-}]_{0^{}}/[Ag^{+}]_{0}}](https://img.franco.wiki/i/ed8e4ff242b2d73b7c008d9ea7cee66599fa54a3.svg)


![{\displaystyle [OH^{-}]_{i^{}}}](https://img.franco.wiki/i/b550c62051cba4fe4c8b63f03fe0412520b5a78c.svg)