FADD
FADD (de l'anglais : Fas-Associated protein with Death Domain), également appelé MORT1, est une protéine humaine encodée par un gène présent dans la région 11q13.3 du chromosome 11 humain et impliquée dans différents processus dont l'apoptose extrinsèque, la nécroptose et la prolifération[1].
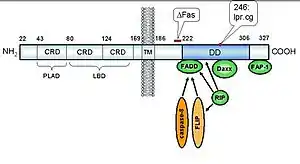
FADD est une protéine adaptatrice, faisant le lien entre les récepteurs de mort (tels que FasR ou TRAIL-R2) et les caspases initiatrices 8 et 10 dans un complexe de haut poids moléculaire appelé DISC (Death-Inducing Signaling Complex)[2].
Structure
FADD est une protéine de 23 kDa pour 280 acides aminés. Elle contient un domaine de mort (DD) en N-terminal et un domaine effecteur de mort (en) (DED) en C-terminal. Ces deux domaines ont une structure très similaire et sont chacun constitués de 6 hélices alpha. Le DD permet un recrutement par des liaisons électrostatiques à d'autres protéines contenant un DD[3], tandis que le DED permet un recrutement par des liaisons hydrophobes à d'autres protéines contenant un DED[4].
Fonction
Apoptose extrinsèque
FADD possède un rôle clé dans l'apoptose extrinsèque, dont l'un des médiateurs principaux est le récepteur Fas. Pour prendre cet exemple, l'activation de FasR par son ligand induit un changement de conformation des récepteurs et le recrutement de FADD par des interactions homotypiques entre les deux DD respectifs. FADD permet ensuite le recrutement des caspases initiatrices 8 et 10 pour former un complexe de haut poids moléculaire appelé le DISC (Death-Inducing Signaling Complex)[2]. La formation de ce complexe entraîne, par un effet de proximité, l'autoclivage des caspases 8 et 10 qui sont alors relarguées dans le cytosol sous une forme dimérique active et poursuivent le processus d'apoptose[5].
Nécroptose
FADD est également l'un constituant du complexe ripoptosome qui peut, selon l'environnement cellulaire, induire l'apoptose ou la nécroptose des cellules[6].
Notes et références
- (en) Kim PKM, Dutra, AS, Chandrasekharappa SC, Puck JM, « Genomic structure and mapping of human FADD, an intracellular mediator of lymphocyte apoptosis », Journal of Immunology, vol. 157, no 12, , p. 5461–5466. (PMID 8955195)
- (en) Bodmer JL, Holler N, Reynard S, Vinciguerra P, Schneider P, Juo P, Blenis J, Tschopp J, « TRAIL receptor-2 signals apoptosis through FADD and caspase-8 » Nat Cell Biol. 2000;2(4):241-3.
- (en) Jeong EJ, Bang S, Lee TH, Park YI, Sim WS, Kim KS, « The solution structure of FADD death domain. Structural basis of death domain interactions of Fas and FADD » J Biol Chem. 1999;274(23):16337-42.
- (en) Eberstadt M, Huang B, Chen Z, Meadows RP, Ng SC, Zheng L, Lenardo MJ, Fesik SW, « NMR structure and mutagenesis of the FADD (Mort1) death-effector domain » Nature. 1998;392(6679):941-5.
- (en) Boatright KM, Renatus M, Scott FL, Sperandio S, Shin H, Pedersen IM, Ricci JE, Edris WA, Sutherlin DP, Green DR, Salvesen GS, « A unified model for apical caspase activation » Mol Cell. 2003;11(2):529-41.
- (en) Feoktistova M, Geserick P, Kellert B, Dimitrova DP, Langlais C, Hupe M, Cain K, MacFarlane M, Häcker G, Leverkus M, « Pick your poison: the Ripoptosome, a cell death platform regulating apoptosis and necroptosis » Cell Cycle. 2012;11(3):460-7. DOI 10.4161/cc.11.3.19060