Extraction par sorption sur barreau magnétique
L'extraction par sorption sur barreau magnétique ou en anglais Stir bar sorptive extraction (SBSE) est introduite en 1999 dans le but de pousser les limites de la microextraction sur phase solide. Elle permet d’extraire des quantités extrêmement petites d’analytes dans une matrice sans utiliser de solvants[1].
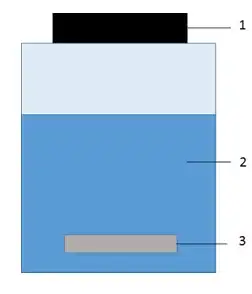
Cette technique a été principalement développée pour l’échantillonnage en phase liquide des composés organiques et est basée sur l’absorption de l’analyte dans une résine de polydiméthylsiloxane (PDMS)[2].
Fonctionnement global
La SBSE est une technique similaire à celle de la microextraction sur phase solide (SPME, Solid-phase microextraction) et est principalement basée sur la sorption et la désorption de l'analyte. Pour procéder à l’extraction, un barreau magnétique est enrobé d’un polymère servant de résine absorbante, la plupart du temps le PDMS. L’extraction est contrôlée par le coefficient de partage entre le polymère et la matrice et par le ratio entre le volume de PDMS et la matrice. Pour une résine de polydiméthylsiloxane et un composé aqueux, le coefficient est comparable à celui de l’octanol/eau (). Pour la désorption, elle peut se faire soit par désorption thermique, ou par désorption liquide. La SBSE est principalement utilisée dans l’analyse de trace dans le domaine de l’environnement, de l’alimentation et du domaine biomédical[2]. En combinaison avec d’autres appareils analytiques, par exemple un chromatographe en phase gazeuse ou un spectromètre de masse, cette technique permet d’obtenir des résultats plus rapide et plus précis qu'un SPME.
Principe
Extraction
L’extraction est techniquement basée sur l’équilibre entre la phase stationnaire et la phase mobile ainsi que sur le coefficient de distribution de l’octanol/eau (). Plusieurs études ont démontré une certaine corrélation pour affirmer que [2]. Avec cette similarité, il est possible d’obtenir une bonne indication pour savoir si et comment le composé peut être extrait par SBSE ou SPME. De plus, à l’aide de l’équation suivante, il est possible de voir que l’équilibre de la sorption est dépendant du ratio de phase (B) et de la quantité de polydiméthylsiloxane ().
Le coefficient de distribution () entre le polydiméthylsiloxane et l’eau est défini comme un ratio à l’équilibre entre la concentration de l'analyte dans le PDMS et l’eau[2]. En introduisant une nouvelle équation, il est possible de combiner l’équation 1 et 2 pour déterminer la récupération théorique (R), à condition d’être à l’équilibre[3].
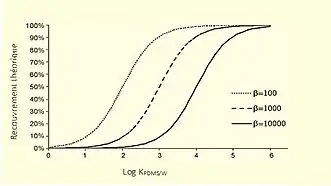
À l'aide de l'équation 3, l’efficacité de l’extraction, donc la récupération, augmente lorsque la constante de distribution () augmente aussi. De plus, plus la quantité de PDMS appliqué est grande, plus le ratio de phase 𝛽 est petit, donc plus la récupération est bonne. D’ailleurs, le ratio de phase est défini comme le ratio entre le volume d’eau et le volume de PDMS. Tel que montré dans la figure ci-contre, la récupération théorique est augmentée lorsque de petits ratios de phase sont utilisés[3].
De plus, pour l'analyse de traces, il n’y a pas seulement la récupération théorique qui est importante, mais aussi le facteur d’enrichissement et la quantité absolue totale pour que l’échantillon soit analysé par chromatographie liquide ou chromatographie gazeuse. Par contre, cette prédiction peut être déterminée par la récupération théorique et le volume de l’échantillon[2]. Somme toute, il est possible de voir que pour des solutés apolaires, la quantité extraite augmente proportionnellement en fonction de la quantité de l’échantillon. Il est donc logique de dire que plus la matrice est grande, plus la quantité récupérée sera grande. Par contre, lorsqu’il est question de soluté polaire, il n’y a pas de corrélation qui a été établie. Alors, de façon générale, il n’a pas de fonction qui permet directement de relier la quantité d’échantillons à la quantité de récupération.
Désorption thermique
Une fois l'extraction terminée, le barreau est retiré de l'échantillon, rincé à l'eau distillée pour retirer les sels et protéines pouvant être présentes et séché à l'aide d'un tissue. L'analyte n'est pas perdu lors du rinçage puisqu'il est absorbé dans le polymère de PDMS. Pour la SBSE combinée à un chromatographe en phase gazeuse, il faut alors une unité de désorption thermique pour vaporiser l'analyte, puis le refroidir avant l'entrée dans le GC. La désorption thermique est efficace, mais elle se limite aux composés volatils et thermiquement stables et au couplage avec un GC. Elle est préférable que la désorption liquide[3] - [2].
Désorption liquide
Si l'analyte est trop sensible à la chaleur, non volatile ou que l'accès à une unité de désorption thermique dispendieuse est impossible, il est possible de faire une désorption liquide à l'aide d'un solvant. Pour ce faire, une fois l'extraction terminée, le barreau est plongé dans un volume minimum possible de solvant compatible pour solvater l’analyte afin de recouvrir le barreau. Les solvants les plus utilisés sont le méthanol, l'acétonitrile, un mélange des deux ou un mélange de ceux-ci avec de l'eau. Des solvants organiques[4] (par exemple l'hexane[2].), l'isooctane et l'acétate d'éthyle ont aussi été étudiés pour la désorption[3]. L'acétate d'éthyle peut par contre détériorer le PDMS, son utilisation est donc limitée[4]. La désorption liquide est optimale pour des composés ayant une polarité moyenne, puisqu'elle est déterminée par le coefficient de partage octanol/eau, comme mentionné auparavant. Si le composé est trop polaire, il y aura peu d'analytes retenus sur le barreau, mais il sera facile à le désorber. Par contre, si le composé n'est pas assez polaire, bien qu'il y aura beaucoup d'analytes absorbés sur le barreau, il sera difficile de retirer ce dernier. La désorption liquide peut être accélérée en chauffant, en agitant ou par sonification. Cette méthode de désorption peut servir pour l'analyse chromatographique en phase liquide et en phase gazeuse[3].
Comparaison avec la SPME
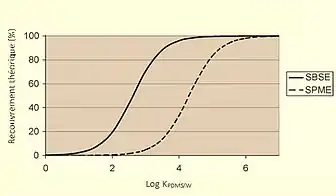
La SPME (Solid Phase Micro Extraction), où communément appelée microextraction sur phase solide, est une technique relativement comparable à celle de la SBSE. Dans celle-ci, la phase stationnaire, qui est greffée à une fibre de silice, détermine la capacité d’extraction. Par exemple, en prenant la SPME, si environ 0,5 uL de polydiméthylsiloxane et un échantillon de 10 mL sont choisis, le ratio de phase obtenu est de 20 000, ce qui est extrêmement élevé, donc la récupération sera très petite. Par contre, avec la SBSE, si nous prenons le même échantillon, un barreau magnétique de 1 cm comportera 25 uL de PDMS, donc le ratio sera de 417. En prenant l’équation 3, il est possible de déterminer la récupération théorique (R). Dans les deux cas, () est de 3. Avec la SPME, la récupération est de seulement 4,8 %, tandis qu’avec le SBSE, la récupération est de 71 %.
L’augmentation de la récupération théorique en utilisant la SBSE au lieu de la SPME a été démontrée par plusieurs groupes de recherche en utilisant des PAHs (polycyclic aromatic hydrocarbons) et des pesticides comme échantillons[2]. Par contre, la SBSE est moins pratique que la SPME. Cette dernière est simple et rapide, puis elle permet de prendre des analyses dans différents endroits sans nécessairement être dans un laboratoire. En effet, si l’échantillon est bien entreposé, il peut être conservé quelques jours avant d’être analysé sans avoir de perte significative.
Le polydiméthylsiloxane (PDMS)
Le PDMS a été choisi pour cette technique, car il possède plusieurs avantages. Premièrement, comparativement aux autres adsorbants, les analytes ne sont pas activement retenus sur la surface, mais ils sont divisés dans la fibre de la résine. Du fait que l’absorption est un processus plus faible que l’adsorption dans le PDMS, la dégradation des analytes instables est pratiquement absente, ce qui permet d’avoir une précision accrue. Deuxièmement, du fait que le PDMS à des interactions plus faibles avec l’analyte, l’échantillon peut être désorbé à des températures plus basses, ce qui réduit le risque d'endommager l'analyte.
Troisièmement, la capacité de rétention du PDMS n’est pas influencée par la quantité d’eau et d’autres composés tant que tous les solutés possèdent leurs propres équilibres de partage. Quatrièmement, la dégradation des fragments du PDMS peut être facilement identifiée par un détecteur de masse sélectif, ce qui augmente la précision de cette technique[1].
Méthodologie

La première étape dans un laboratoire est la préparation du barreau magnétique. Un barreau magnétique est placé dans un moule en Téflon et un mélange de PDMS est ajouté. Le moule est d’abord mis dans une étuve pendant une heure à 60 °C. Ce dernier est laissé à reposer à température de la pièce avant de couler le mélange. Le mélange est formé sous un ratio 10:1 de phase visqueuse (environ 0,3 g) et d’agent durcisseur (0,03 g). Le moule est pressé et placé dans une étuve pendant 30 min a 40 °C et ensuite sous un gradient de température de 10 °C/min jusqu’à 250 °C (120 min).
Le temps d’extraction varie en fonction de l’analyte en question. La troisième étape consiste à récupérer l’analyte par désorption comme mentionné auparavant. L'analyte est habituellement retiré du barreau par désorption thermique en chauffant à des températures entre 150 et 300 °C pendant une période pouvant atteindre 15 min. La dernière étape consiste à analyser le composé souvent par chromatographie. Ce processus est souvent relié directement au mécanisme de désorption afin de minimiser les pertes et les contaminations.
Application : matrice et types d'analytes
La SBSE a premièrement été utilisée pour l'extraction de composés organiques semi-volatils de l'eau lors d'analyse environnementale effectuée par chromatographie sur phase gazeuse. Elle a servi pour la détection et la quantification de composés dans l'eau tels que des pesticides, des hormones, des explosifs et des composés odorants. La SBSE a ensuite été utilisée pour l'extraction de composés organiques dans le sol après avoir fait une extraction liquide-liquide de l'échantillon[2].
Différentes applications dans le domaine alimentaire ont ensuite été développées: La détection de contaminants, de composés responsables d'odeurs et de composés présents en petite quantité dans la nourriture[2]. La SBSE peut aussi être utilisée dans le domaine biomédical pour la détection et la quantification de composés organiques dans l'urine, la salive, le plasma sanguin, etc[2].
Avantages
L'avantage principal de la SBSE est qu'elle combine les avantages de la SPE (extraction sur phase solide, solid phase extraction) et de la SPME. En effet, elle permet de travailler avec des volumes de sorbants plus élevés que dans la SPME, ce qui permet une récupération de plus d'analytes dans la phase stationnaire, en plus d'être plus simple d'utilisation que la SPE. Le prix peu élevé de cette méthode est un autre avantage à prendre en compte[3]. De plus, l'absence de solvants dans cette méthode fait de celle-ci une méthode plus écologique que les extractions par solvants[2].
Inconvénients
Un des inconvénients est le temps de manipulation et les erreurs qui peuvent être introduites lorsque le barreau est retiré de l'échantillon, rincé, puis séché. L'automatisation de ces étapes peut être faite, mais elle peut être laborieuse et coûteuse. De plus, la SBSE est limitée à un certain type d'analytes, puisque les barreaux recouverts de PDMS sont présentement le seul type de barreaux pour SBSE vendu commercialement[3]. Une solution potentielle étudiée est un barreau à enrobage de phase mixte (dual-phase-coated stir bar) qui consiste en un barreau pour SBSE enrobé de deux sorbants, généralement du PDMS et un adsorbant tel que le charbon activé[3].
Optimisation
La SBSE dépend de l'extraction et de la désorption, comme mentionnée auparavant. Il est alors possible d'optimiser ces deux composantes afin d'obtenir une extraction plus efficace et plus rapide. L'approche est systématique où une variable est modifiée à la fois. Cette méthodologie est très longue puisqu’il existe de nombreuses variables influençant la SBSE. De plus, l’approche à une variable ne démontre pas les relations qui peuvent exister entre chacun des paramètres expérimentaux. Une solution à ces problèmes est d’utiliser une approche plan d'expérience (Designs of Experiments).
Les variables qui influencent le plus l’extraction sont la durée de l’expérience, l’influence du pH de la solution, l’addition de sel inerte, l’addition d’une substance organique, la vitesse du barreau magnétique, la température ainsi que le volume de la phase d’extraction. Le temps d’extraction a un impact majeur sur la constante d’équilibre. Si le temps d’extraction est court, il est possible que l’équilibre entre la phase stationnaire et la phase mobile ne soit pas atteint. L’extraction est alors incomplète et imprécise. Certains auteurs préfèrent sauver du temps et donc travailler sous des conditions hors-équilibre[3].
Lorsqu’il s’agit d’analyte de nature acidique ou basique, le pH de la solution joue un rôle important. Selon le pKa, une substance peut se retrouver sous la forme ionique ou non dépendamment du pH. Il est préférable d’avoir un pH qui favorise une forme plutôt que deux. Il faut donc assurer que le pH est assez différent, soit de deux unité, du pKa. Un inconvénient d’optimiser le pH est que ce dernier est limité. Un pH trop acide (< 2) ou trop basique (> 9) peut détériorer la couche de PDMS[3].
Il est possible d’ajouter un sel inerte, par exemple du chlorure de sodium, à la solution pendant l’extraction. Cet ajout a un impact majeur sur la force ionique. La concentration d’un produit, soit son activité, est proportionnelle à la force ionique, d’où ce dernier perturbe la constante de partage. De plus, le sel diminue la solubilité de l’analyte en solution, le rendant plus accessible. Il est cependant observé que le rendement d’une extraction d’un analyte hydrophobe, soit non-polaire est diminué tandis que celle d’un analyte hydrophile, soit polaire, est augmenté comme prévu. Plusieurs hypothèses suggèrent que l’ajout d’un sel augmente la viscosité de la solution, la rendant similaire à une huile. Il est alors plus difficile pour un analyte de migrer, diminuant la cinétique du système[3].
Il est également possible d’ajouter une substance organique à la solution dans le but de minimiser l’adsorption d’analyte sur les parois du contenant. Le méthanol, l’acétonitrile sont les principaux additifs organiques. Il est important de considérer la solubilité de l’analyte dans ces différents solvants. Ces derniers peuvent causer une hausse de solubilité du composé à étudier, diminuant ainsi l’efficacité de l’extraction. De plus, par exemple, la concentration de méthanol doit être optimisée. On aperçoit qu’une concentration de 5 % de méthanol augmente le rendement d’extraction de pesticides tandis qu’une concentration supérieure le diminue[3].
Il est possible d’optimiser la vitesse à laquelle le barreau tourne. Il est préférable d’avoir une vitesse de rotation grande puisque celle-ci diminue l’épaisseur de la couche de molécule qui se trouve entre le barreau et la solution améliorant ainsi l’extraction. Par contre, la vitesse de rotation est limitée puisque celle-ci peut endommager la phase d’extraction due au contact violent entre le barreau magnétique et le contenant. La vitesse optimale de rotation se trouve à être entre 500-750 tr/min dans la majorité des cas[3].
L’optimisation de la température est semblable à celle de la vitesse. Une température inférieure à 40 °C et supérieure à 70 °C diminue la durée de vie de la phase PDMS. La température influence en premier lieu le temps que prend le système à atteindre l’équilibre, et en deuxième lieu le coefficient de partage,le diminue, résultant en la diminution de l’efficacité. Il est alors important d’optimiser la température en fonction de l’analyte puisque les effets varient selon ce dernier.
A l’aide de l’équation 1 et 3, il est évident d’optimiser la masse de la phase mobile et de la phase aqueuse d’où le rendement varie de façon proportionnelle au rapport entre les deux composantes. En addition, plusieurs recherches démontrent que le volume du barreau enrobé de PDMS n’affecte pas l’efficacité de l’extraction[3].
Il est également possible d’optimiser la désorption, soit thermique soit liquide. Lorsqu’il s’agit d’une désorption thermique, la température ainsi que la température de cryofocalisation (cryofocusing) sont étudiées[3]. Il est préférable d’utiliser la température minimale requise afin de minimiser le risque d’endommager la couche de PMDS. Il est également possible d’utiliser des températures plus basses en allongeant le temps de désorption. Il faut également ajuster la température de cryofocalisation afin de bien récupérer les analytes avant de faire une chromatographie. De basses températures de cryfocalisation sont nécessaires pour des analytes volatils. Lorsqu’il s’agit d’une désorption liquide, la nature du solvant, le temps de désorption ainsi que le volume utilisé sont importants à optimiser. Le volume de solvant utilisé doit être au minimum, soit juste assez pour couvrir le barreau enrobé entièrement. Ceci permet d’avoir la plus grande concentration d’analyte. L’optimisation du temps de désorption et de la nature du solvant se procèdent de la même façon que mentionné auparavant. La sonification de la solution améliore la désorption liquide.
HSSE
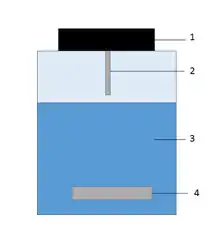
La HSSE (head-space sorptive extraction) est une variante de la SBSE utilisée pour séparer des composés organiques volatils d'une matrice liquide ou gazeuse. L'échantillon est introduit dans un vial fermé et agité à l'aide d'un barreau magnétique pour favoriser le passage des composés volatils de la phase liquide à la phase gazeuse. Un barreau recouvert de PDMS est suspendu au bouchon dans la phase gazeuse de façon à absorber les composés volatils[3]. La désorption se fait de la même façon que lors de la SBSE (voir précédemment)[3].
Notes et références
- (en) Erik Baltussen, Pat Sandra, Frank David, Carel Cramer (1999), Stir Bar Sorptive Extraction (SBSE), a Novel Extraction Technique for Aqueous Samples: Theory and Principles, J. Microcolumn Separation, 11, 737-747
- Frank David, Pat Sandra (2007), Stir bar sorptive extraction for trace analysis, Journal of Chromatography A, 1152, 54-69.
- A.Prietoa, O. Basauria, R. Rodilb, A. Usobiagaa, L.A. Fernándeza, N. Etexebarriaa, O. Zuloaga, (2010) Stir-bar sorptive extraction: Aview on method optimisation, novel applications, limitations and potential solutions, Journal of Chromatography A, 1217, 2642-2666.
- Paula Grossi, Igor R. B. Olivares, Diego R. de Freitas, Fernando M. Lancas, A novel HS-SBSE system coupled with gas chromatography and mass spectrometry for the analysis of organochlorine pesticides in water samples, J. Sep. Sci. 31, 2008, 3630 – 3637.




