Extraction au phénol-chloroforme
L'extraction à l'acide de guanidinium thiocyanate-phénol-chloroforme (en abrégé AGPC) est une technique d'extraction liquide-liquide en biochimie. EIle est largement utilisée en biologie moléculaire pour isoler l'ARN (ainsi que l'ADN et les protéines dans certains cas). Cette méthode peut prendre plus de temps qu'un système à base de colonne tel que la purification à base de silice, mais a une pureté plus élevée et l'avantage d'une récupération élevée de l'ARN : [citation nécessaire] une colonne d'ARN ne convient généralement pas à la purification d'espèces d'ARN courtes (<200 nucléotides), telles que le siRNA, miRNA, gRNA et les ARNt.
Il a été conçu à l'origine par Piotr Chomczynski et Nicoletta Sacchi, qui ont publié leur protocole en 1987.[ 1][2] Le réactif est vendu par Sigma-Aldrich sous le nom de TRI Reagent ; par Invitrogen sous le nom de TRIzol ; par Bioline sous le nom de Trisure ; et par Tel-Test sous le nom de STAT-60.
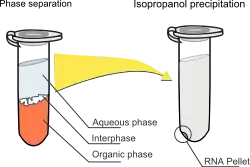
Cette méthode repose sur la séparation des phases par centrifugation d'un mélange de l'échantillon aqueux et d'une solution contenant du phénol et du chloroforme saturés en eau, résultant en une phase aqueuse supérieure et une phase organique inférieure (principalement du phénol). Le thiocyanate de guanidinium, un agent chaotropique, est ajouté à la phase organique pour aider à la dénaturation des protéines (telles que celles qui lient fortement les acides nucléiques ou celles qui dégradent l'ARN). Les acides nucléiques (ARN et/ou ADN) se répartissent dans la phase aqueuse, tandis que les protéines se répartissent dans la phase organique. Le pH du mélange détermine quels acides nucléiques sont purifiés[1]. Dans des conditions acides (pH 4-6), l'ADN se répartit dans la phase organique tandis que l'ARN reste dans la phase aqueuse. Dans des conditions neutres (pH 7-8), l'ADN et l'ARN se répartissent dans la phase aqueuse. Dans une dernière étape, les acides nucléiques sont récupérés de la phase aqueuse par précipitation au 2-propanol (isopropanol). Le 2-propanol est ensuite lavé avec de l'éthanol et le culot est brièvement séché à l'air et dissous dans du tampon TE ou de l'eau sans ARNase.
Le thiocyanate de guanidinium dénature les protéines, y compris les RNases, et sépare l'ARNr des protéines ribosomiques, tandis que le phénol, l'isopropanol et l'eau sont des solvants peu solubles. En présence de chloroforme ou de BCP ( bromochloropropane ), ces solvants se séparent entièrement en deux phases reconnaissables à leur couleur : une phase aqueuse supérieure limpide (contenant les acides nucléiques) et une phase inférieure (contenant les protéines dissoutes dans le phénol et les lipides dissous dans du chloroforme). D'autres produits chimiques dénaturants tels que le 2-mercaptoéthanol et la sarcosine peuvent également être utilisés. Le principal inconvénient est que le phénol et le chloroforme sont à la fois des matériaux dangereux et peu pratiques, et que l'extraction est souvent laborieuse. Ainsi, ces dernières années, de nombreuses entreprises proposent désormais d'autres moyens d'isoler l'ARN.
Réactifs
- Phénol : Le phénol utilisé en biochimie se présente sous la forme d'une solution saturée d'eau avec du tampon Tris, d'une solution tamponnée Tris à 50 % de phénol, 50 % de chloroforme ou d'une solution tamponnée de Tris à 50 % de phénol, 48 % de chloroforme, 2 % d'alcool isoamylique (parfois appelée "25:24:1"). Le phénol est naturellement peu soluble dans l'eau et donne une interface floue, qui est accentuée par la présence de chloroforme, et l'alcool isoamylique qui réduit le moussage. La plupart des solutions contiennent également un antioxydant, car le phénol oxydé endommage les acides nucléiques. Pour la purification de l'ARN, le pH est maintenu autour de 4, ce qui retient préférentiellement l'ARN dans la phase aqueuse. Pour la purification de l'ADN, le pH est généralement proche de 7, point auquel tous les acides nucléiques se trouvent dans la phase aqueuse.
- Chloroforme : Le chloroforme est stabilisé avec de petites quantités d'amylène ou d'éthanol, car l'exposition du chloroforme pur à l'oxygène et à la lumière ultraviolette produit du gaz phosgène. Certaines solutions de chloroforme se présentent sous la forme d'un mélange préfabriqué à 96% de chloroforme et 4% d'alcool isoamylique qui peut être mélangé avec un volume égal de phénol pour obtenir la solution 25:24:1.
- Alcool isoamylique : L'alcool isoamylique peut réduire la formation de mousse et assurer la désactivation des RNases.
Articles connexes
- Purification d'acide nucléique sur colonne
- Méthodes d'acide nucléique
- Précipitation d'éthanol
- Séparation d'ADN par adsorption de silice
Notes et références
- Perry RP, La Torre J, Kelley DE, Greenberg JR. (1972) On the lability of poly(A) sequences during extraction of messenger RNA from polyribosomes. Biochim. Biophys. Acta 262: 220–226; Brawerman G, Mendecki J, Lee SY. (1972) A procedure for the isolation of mammalian messenger ribonucleic acid. Biochemistry 11: 637–641.