Erysiphe alphitoides
Erysiphe alphitoides (anciennement Microsphaera alphitoides) est une espèce de champignons ascomycètes de la famille des Erysiphaceae. parasite biotrophe obligatoire, ce champignon phytopathogène est l'une des espèces responsables de l'oïdium du chêne.

Historique
Apparu en France en 1907, c'est seulement en 1911 que les chasmothèces, qui correspondent à la forme sexuée ou parfaite, ont été observés et décrits, jusqu'ici seule la forme anamorphe ou imparfaite avait été décrite. Les chasmothèces ont d’abord été identifiés comme étant de l’espèce Microsphaera quercina responsable de la maladie en Amérique. Une étude morphologique approfondie établit qu’il s’agissait en réalité d’une espèce non encore décrite[2]. On proposa l’espèce Microsphaera alphitoides (actuellement Erysiphe alphitoides) qui doit son nom à la racine grecque aleuri (αλευρί) qui signifie farine faisant ainsi référence à l’abondance des spores blanches produites par le champignon.
Erysiphe alphitoides est actuellement observable sous ses deux formes (anamorphe et téléomorphe) en France.
Morphologie
D'après S. Takamatsu et al.[1]
Forme téléomorphe (sexuée)
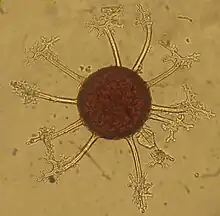
- Asque :
- forme ellipsoïdale à ovoïde
- contient 8 ascospores
- Ascospores :
- hyalines
- forme ellipsoïdale à ovoïde
- Chasmothèces :
- sphériques
- 70 à 140 µm de diamètre
- Fulcres :
- 5 à 25 en position équatoriale
- longueur entre 0,75 et 2 × diamètre du chasmothèce
- aseptés ou (rarerment) uniseptés
- 4 à 6 ramifications dichotomiques
Forme anamorphe (asexuée)
- Conidies :
- ellispoïdes en formation, doliiformes à maturité
- 25 à 45 × 13 à 25 µm
Mycélium
- Hyphes :
- ramifiés
- blancs diffus ou en spots
- septés
- 3 à 7 µm de diamètre
- Apressorium
- lobé
- un seul ou en paires opposées
- 6 à 10 µm de diamètre
Cycle biologique et dispersion
.jpg.webp)
Le champignon réalise plusieurs cycles par an, chaque cycle étant composé de 3 phases principales : infection, sporulation, conservation[5].
Seules les jeunes feuilles non totalement développées sont sensibles à l’infection ; 15-20 jours après le débourrement on estime que la période de sensibilité est terminée[6]. En général, la maladie se développe assez tardivement au printemps à la fin du développement des feuilles de première unité de croissance. La maladie est généralement beaucoup plus sévère sur les feuilles de deuxième et troisième unité de croissance[7].
La période d’hivernation est une période critique pour les oïdiums. En effet, ces champignons sont des biotrophes obligatoires, il leur faut donc survivre en dehors de la période de disponibilité de leur hôte. E. alphitoides passe cette période sous forme de chasmothèces (organe de dormance qui contient les asques), sur des feuilles mortes de la litière et surtout sous forme de mycélium peu actif dans les bourgeons (hôte pérenne)[8].
Les ascospores germent à la surface des feuilles de l’hôte, le tube germinatif se différenciant en appressorium qui permet la pénétration des cellules épidermiques. L’essentiel du développement du champignon est épiphylle[5], il assure sa nutrition grâce aux haustoria.
L’essentiel de la reproduction est asexuée, les conidies en sont le résultat. Elles sont formées sur le mycélium à la surface des feuilles, ce sont elles qui sont disséminées et qui permettent les infections secondaires. La sporulation et la dissémination ont lieu pendant toute la période de végétation de l’hôte. L’inoculum est disséminé par le vent[9].
Taxinomie
- synonymes
- Erysiphe quercina Schwein., (1834)
- Microsphaera alphitoides Griffon & Maubl., (1912)
- Microsphaera quercina (Schwein.) Burrill, (1887)
- Oidium alphitoides Griffon & Maubl., (1910)
- Oidium quercinum Thüm.
- Phyllactinia quercus (Mérat) Homma, (1937)
Références taxinomiques
- (en) Référence Index Fungorum : Erysiphe alphitoides (+ MycoBank)
Notes et références
- Takamatsu, S., Braun, U., Limkaisang, S., Kom-Un, S., Sato, Y., Cunnington, J. H., « Phylogeny and taxonomy of the oak powdery mildew Erysiphe alphitoides sensu lato », Mycological Research, no 111 (2007), p. 809-826.
- Griffon et Maublanc in DESPREZ-LOUSTAU, M.-L. 2002 : L’oïdium du chêne une maladie fréquente mais mal connue. Les cahiers du DSF, 1-2002, p. 95-99
- Feuilles de jeune chêne ou sur les branches basses car ce parasite obligatoire se développe en milieu humide et ombragé, les facteurs abiotiques tels qu'un fort ensoleillement entraînant une sécheresse excessive. Erysiphe se développe aussi sur les semis trop denses ou dans les cultures ayant reçu trop d'engrais azotés. cf. (en) Karla Longrée, The Effect of Temperature and Relative Humidity on the Powdery Mildew of Roses, Cornell University, , p. 14
- La surface de la feuille grattée apparaît dessous, verte et marbrée de brun-jaune par la production de tannins toxiques qui restent accumulés en vain dans la vacuole. Le parasite n'altère pas les cellules épidermiques, ce qui rend la réaction de défense du chêne contre lui sans effet. cf.Marc-André Selosse, Les Goûts et les couleurs du monde. Une histoire naturelle des tannins, de l'écologie à la santé, Actes Sud Nature, , p. 93
- GLAWE, D. A., 2008 : The powdery mildews : a review of the world’s most familiar (yet poorly known) plant pathogens. Annual Review of Phytopathology 46, p. 27-51.
- DESPREZ-LOUSTAU, M.-L., VITASSE, Y., DELZON, S., CAPDEVIELLE, X., MARÇAIS, B., KREMER, A. 2010 : Are plant pathogen populations adapted for encounter with their host ? A case of phenological synchrony between oak and an obligate fungal parasite along an altitudinal gradient. Journal of Evolutionary Biology 23, p. 87-97
- MARÇAIS, B., KAVKOVA, M., DESPREZ-LOUSTAU, M.-L. 2009, « Phenotypic variation in the phenology of ascospore production between European populations of oak powdery mildew », Annals of Forest Science, vol. 66, p. 814.
- (en) Benoit Marçais, Miloslava Kavkova, Marie-Laure Desprez-Loustau, « Phenotypic variation in the phenology of ascospore production between European populations of oak powdery mildew », Annals of Forest Science, vol. 66, no 8, , p. 814–814 (DOI 10.1051/forest/2009077)
- LANIER, L., JOLY, P., BONDOUX, P., BELLEMERE, A. 1976 : Pathologies des essences feuillues : Maladies des Chênes : III. Maladie des feuilles : l’oïdium ou « blanc » du chêne. In Mycologie et Pathologie Forestières Tome II : Pathologie forestière. Paris : Masson, 1976, p. 316-318