Détente de Joule-Gay-Lussac
La détente de Joule Gay-Lussac, du nom de Joseph Louis Gay-Lussac[1], est une détente adiabatique irréversible dans le vide. Pendant cette expérience, l'énergie interne du système reste constante : elle est donc isoénergétique.
On en déduit la première loi de Joule : « l'énergie interne d'un gaz parfait ne dépend que de sa température ».
Description de l'expérience
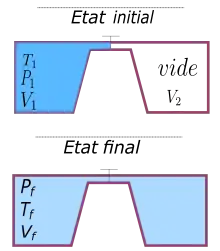
On considère deux récipients de volume et de volume , aux parois calorifugées et indéformables, pouvant communiquer au moyen d'un robinet. Le premier, , contient un gaz sous la pression et à la température . Le deuxième, , est initialement vide.
On ouvre le robinet. Le gaz se répand dans . Cette diffusion est un processus spontané, puisqu'aucune action extérieure n'est nécessaire pour que le gaz diffuse, et non renversable, puisqu'une fois le récipient rempli il ne se revide pas spontanément : la transformation est donc irréversible. L’état final du gaz est .
Pour un gaz parfait, on constate expérimentalement que .
Interprétation
Le système considéré pour les deux calculs ci-dessous regroupe les deux récipients et , de volume total .
Calcul de la variation d'énergie interne
Soit la variation d'énergie interne du système considéré. D'après le premier principe de la thermodynamique on a :
La transformation est adiabatique, il n'y a pas d'échange de chaleur avec l'extérieur, donc . De plus, le volume du gaz varie mais aucun travail n'est produit par le gaz (puisque l'enceinte 2 est vide), d'où . On en conclut que :
L'énergie ne varie pas, . Pour un gaz parfait, selon la première loi de Joule, l'énergie interne ne dépend que de la température : avec la capacité thermique isochore (à volume constant). Par conséquent la température ne varie pas, .
Calcul de la variation d'entropie
On considère la transformation réversible associée qui passe par le même état initial () et le même état final (). D'après le premier principe de la thermodynamique, puisque la transformation est isoénergétique et réversible :
On obtient, d'après la loi des gaz parfaits :
On intègre et on obtient finalement :
Si le volume double (), la variation d'entropie molaire est de 5,76 J/(K·mol).
Gaz réel
Pour un gaz suivant l'équation d'état de van der Waals :
- .
Pour , on a donc :
En intégrant, on obtient :
Comme , et , on en déduit que .
Dans une détente de Joule-Gay-Lussac, un gaz de van der Waals ne peut que refroidir (lorsque son volume augmente à énergie constante sa température diminue). C'est le cas de la majorité des gaz réels, à l'exception notable de l'hélium, de l'hydrogène et de certains gaz rares qui se réchauffent sous certaines conditions de température initiale dans une détente de ce type[2] - [3].
Voir aussi
Références
- Les équipements qui servirent à Gay-Lussac lors de ses expériences sont conservés à l'École polytechnique. L’appareil à deux globes de verre : Gay-Lussac et Regnault ?. Le laboratoire de Gay-Lussac.
- Notes de cours d'électrostatique, p. 79, Groupe de Physique Statistique, Equipe 106, Institut Jean Lamour, université de Lorraine.
- J.-O. Goussard et B. Roulet, « Free expansion for real gases », Am. J. Phys., vol. 61, no 9, , p. 845–848 (DOI 10.1119/1.17417, Bibcode 1993AmJPh..61..845G).
Lien externe
- J.-Ph. Qadri (Académie de Bordeaux), « T4 – Appendice 1 - Détentes de Joule - Bilans énergétique et entropique » [PDF], sur webetab.ac-bordeaux.fr (consulté le ), p. 2-3.































