Cycle visuel
Le cycle de la vision, ou cycle visuel, est régi par la photoisomérisation du rétinal. Lorsque le rétinal 11-cis absorbe un photon, il passe de l'état 11-cis à l'état tout-trans. Cette isomérisation est à l'origine de l'influx nerveux par phototransduction. Le rétinal 11-cis est ensuite régénéré par voie enzymatique.
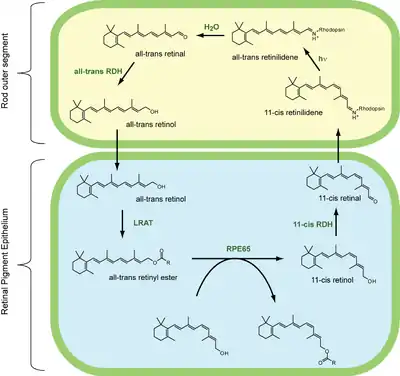
Dans le détail, le cycle visuel dans une cellule bâtonnet de mammifère comprend sept étapes. Les étapes 1, 2 et 7 se déroulent dans les cellules de l'épithélíum pigmentaire de la rétine (EPR). Les étapes 3 à 6 ont lieu dans les segments extérieurs des cellules bâtonnets.
Principe
Isomérisation du rétinol et hydrolyse de la liaison ester
Tout-trans-rétinyl ester H2O → 11-cis-rétinol + acide gras par une RPE65 isomérohydrolase[1].
Oxydation du rétinol
11-cis-rétinol + NAD+ → 11-cis-rétinal + NADH + H+ par une 11-cis-rétinol déshydrogénase.
Passage dans un bâtonnet (segment externe).
Fixation du 11-cis rétinal sur l'aporhodopsine par formation d'une imine
11-cis-retinal + aporhodopsine → rhodopsine + H2O
Capture du signal photonique, le 11-cis rétinène est isomérisé en tout-trans
Rhodopsine + hν → métarhodopsine II
Hydrolyse spontanée de l'imine, libération du rétinal
Métarhodopsine H2O → aporhodopsine + tout-trans-rétinal
Réduction du rétinal
Tout-trans-rétinal + NADPH + H+ → tout-trans-rétinol +NADP+ par une tout-trans-rétinol déshydrogénase.
Estérification du rétinol
Tout-trans-rétinol + acide gras → tout-trans-rétinyl ester + H2O par une lécithine rétinol acyltransférase (LRAT)[2].
Dans ce domaine, le biochimiste George Wald a reçu une partie du prix Nobel de physiologie ou médecine en 1967 pour son travail sur les pigments de la rétine[3].
Références
- (en) Gennadiy Moiseyev, Ying Chen, Yusuke Takahashi, Bill X. Wu et Jian-xing Ma, « RPE65 is the isomerohydrolase in the retinoid visual cycle », Proceedings of the National Academy of Sciences, vol. 102, no 35, , p. 12413–12418 (DOI 10.1073/pnas.0503460102).
- (en) Minghao Jin, Quan Yuan, Songhua Li et Gabriel H. Travis, « Role of LRAT on the Retinoid Isomerase Activity and Membrane Association of Rpe65 », Journal of Biological Chemistry, ASBMB, vol. 282, no 29, , p. 20915–20924 (DOI 10.1074/jbc.M701432200).
- (en) « The Nobel Prize in Physiology or Medicine 1967 », sur nobelprize.org (consulté le )/