Cortex cingulaire postérieur
Le cortex cingulaire postérieur (CCP) est, dans le cerveau, une zone à l'arrière du cortex cingulaire ressemblant à une ceinture entourant le corps calleux.
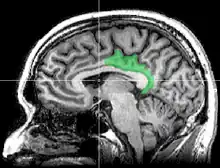
Anatomie
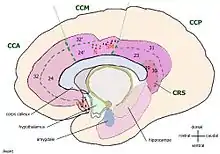
La description du cortex cingulaire en une zone antérieure et une postérieure a été faite par Korbinian Brodmann en 1909 sur la base d'une différence anatomique et dans l'ignorance de leurs fonctions. Dans cet ancien découpage, le cortex cingulaire postérieur (CCP) consiste dans les aires de Brodmann 29, 30, 23, 31, et assure des fonctions évaluatives selon Brent Alan Vogt[1] (1992).
Dans les années 1990, une nouvelle description en quatre parties s'est imposée (Brent A. Vogt[2] 1993) dans laquelle l'ancien cortex cingulaire postérieur s'est retrouvé divisé en :
- cortex cingulaire postérieur CCP, avec le même nom mais limité aux aires 23 et 31
- cortex rétrosplénial CRS, regroupant les aires 29 et 30. Il entoure directement le splenium du corps calleux.
Pour éviter les confusions, Brent A. Vogt appelle l'ensemble formé par le cortex cingulaire postérieur (CCP) et le cortex rétrosplénial (CRS), le gyrus cingulaire postérieur.
Le CCP reçoit en abondance des afférences en provenance de la formation hippocampique, à la différence du CCA qui n'a que peu ou pas d'entrées provenant de l'amygdale.
Le cas d'une patiente présentant un déficit de remémoration des événements personnels, consécutif à une atteinte tumorale du cortex rétrosplénial a été décrit[3]. Le déficit concernait les dix années précédant l'évaluation neuropsychologique et la mémoire antérograde. La mémoire sémantique semblait préservée. L'apprentissage de nouvelles informations verbales était préservé alors que l'apprentissage de matériels visuels était très diminué.
Fonctions
On sait depuis longtemps que le CCP et le CRS sont impliqués dans la remémoration et dans l'orientation topographique[4].
- Activation du CCP lors du rappel de souvenirs autobiographiques et la perception de visages familiers (parents, amis)
La mémoire autobiographique est le système cognitif qui permet à un individu de stocker puis de récupérer les expériences subjectives vécues par lui-même, accompagnées des détails phénoménologiques (perceptions, pensées, sentiments, situés dans leur contexte spatiotemporel) présents lors de l'acquisition.
Une étude de neuro-imagerie de R.J. Maddock et al[5] (2001) a montré que la récupération de souvenirs autobiographiques active un réseau cérébral étendu comprenant le cortex cingulaire postérieur. Ces souvenirs évoqués par l'énonciation de noms de personnes de la famille ou d'amis activaient le plus fortement la partie caudale du CCP gauche. À la même époque, Nadim J. Shah et ses collaborateurs[6] ont montré que la vue de visages ou l'écoute de voix de personnes familières (connues personnellement des sujets) activaient le CCP et le cortex rétrosplénial, indépendamment de la modalité du stimulus. La reconnaissance des visages activait en outre le gyrus fusiforme et la reconnaissance des voix activait aussi le gyrus temporal supérieur, conformément à ce que l'on sait de la fonction de ces modules.
Une méta-analyse[7] de 24 études de neuroanatomie fonctionnelle portant sur la mémoire autobiographique indique que le réseau neuronal principalement activé comporte le cortex préfrontal ventrolatéral et médian, le cortex temporal latéral et médian, la jonction temporopariétale, le cortex cingulaire postérieur/rétrosplénial et le cervelet.
- Désactivation du CCP dans la maladie d'Alzheimer
Le cortex cingulaire postérieur (CCP) et l'hippocampe sont les régions du cerveau connaissant la plus forte réduction d'activité métabolique dans la maladie d'Alzheimer. Ces atteintes cérébrales pathologiques se dissocient de celles observées lors d'un vieillissement normal où c'est l'atrophie des lobes frontaux qui est caractéristique. Une étude de l'Inserm (Grégoria Kalpouzos et al[8] 2009) sur 45 personnes âgées de 20 à 83 ans, a montré que le cortex frontal subit la plus forte détérioration au cours du vieillissement, à la fois structurellement et fonctionnellement, tandis que le CCP, le thalamus et l'hippocampe antérieur étaient les moins affectés. Ainsi, « les zones cérébrales les mieux préservées au cours du vieillissement cérébral normal correspondent aux zones altérées dans la maladie d'Alzheimer. »[8]
Notes
Références
- Brent A. Vogt, David M. Finch and Carl R. Olson, « Functional Heterogeneity in Cingulate Cortex: The Anterior Executive and Posterior Evaluative Regions », Cereb Cortex, vol. 2, no 6, , p. 435-443 (PMID 1477524, DOI 10.1093/cercor/2.6.435-a, lire en ligne)
- Brent A. Vogt, « Structural organization of cingulate cortex: Areas, neurons, and somatodendritic transmitter receptors. », In Neurobiology of Cingulate Cortex and Limbic Thalamus (B. A. Vogt and M. Gabriel, Eds.), pp. 19-70. Birkhäuser,
- Gainotti, Guido, Aimonti, Susanna, DiBetta, Anna Maria, & Silveri, Maria Caterina, « Retrograde amnesia in a patient with retrosplenial tumor », Neurocase, vol. 4, no 6, , p. 519-526 (DOI 10.1080/13554799808410644)
- Brent Vogt (dir.), Cingulate neurobiology and disease, OUP Oxford,
- R. J. MADDOCK, A. S. GARRETT and M. H. BUONOCORE, « REMEMBERING FAMILIAR PEOPLE: THE POSTERIOR CINGULATE CORTEX AND AUTOBIOGRAPHICAL MEMORY RETRIEVAL », Neuroscience, vol. 104, no 3,
- Nadim J. Shah, John C. Marshall, Oliver Zafiris, Anna Schwab, Karl Zilles, Hans J. Markowitsch and Gereon R. Fink, « The neural correlates of person familiarity A functional magnetic resonance imaging study with clinical implications », Brain, vol. 124, no 4, , p. 804-815
- Eva Svoboda, Margaret C. McKinnon, Brian Levine, « The functional neuroanatomy of autobiographical memory: A meta-analysis », Neuropsychologia, vol. 44, , p. 2189-2208
- Grégoria Kalpouzos, Gaël Chételat, Jean-Claude Baron, Brigitte Landeau, Katell Mevel, Christine Godeau, Louisa Barré, Jean-Marc Constans, Fausto Viader, Francis Eustache, Béatrice Desgranges, « Voxel-based mapping of brain gray matter volume and glucose metabolism profiles in normal aging », Neurobiol Aging, vol. 30, no 1, , p. 112-24 (PMID 17630048)