Common Technical Document
Le Common Technical Document (CTD) est un format de dossier servant à la soumission des demandes d'autorisation de mise sur le marché (AMM) d'un médicament par exemple.
Comme son nom l'indique ("document technique commun"), le CTD a pour principal intérêt d'être commun à la plupart des autorités de santé dans le monde (en tout cas les plus importantes : Europe, USA et Japon) pour la soumission d'un dossier de demande d'AMM. Le CTD a été mis au point par l'Agence européenne du médicament EMA, son équivalent américain la FDA (Food and Drug Administration) et japonais (le ministère de la santé, du travail et du bien-être). Il est géré par l'ICH : International Conference of Harmonization, qui harmonise certaines parties de la réglementation des médicaments.
Aujourd'hui le format CTD a remplacé l'ancien format NTA en Europe et est obligatoirement utilisé pour une nouvelle demande d'AMM dans un pays européen.
Il existe aujourd'hui l'eCTD.
Contenu
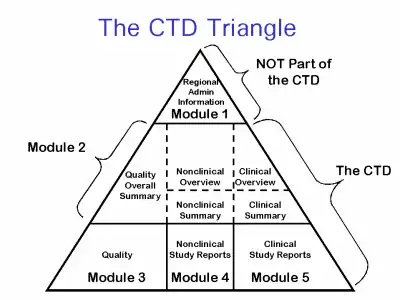
Le format CTD se compose de cinq modules.
Le module 1 est administratif et ne fait pas vraiment partie du CTD car il est spécifique à chaque région (Europe, USA, ...).
Le module 2 regroupe les Résumés des modules 3, 4 et 5.
Le module 3 est le module Qualité. On y trouve le procédé de fabrication de la substance active en 3.2.S et le procédé de fabrication du produit fini (= le médicament) en 3.2.P.
Le module 4 contient les informations non-cliniques (ou pré-cliniques), c'est-à-dire les informations recueillies lors de l'usage du médicament chez l'animal.
Le module 5 contient les informations cliniques, c'est-à-dire les informations recueillies lors de l'usage du médicament chez l'homme. Cela concerne principalement les données des études cliniques, mais aussi après commercialisation les données de pharmacovigilance avec les PSUR.
Autre utilisation
L'intérêt du CTD est qu'il sert également pour un dossier de demande de Drug Master File (DMF) ou de Certificat de conformité à la pharmacopée européenne (CEP) pour une substance active. Le CTD doit servir de trame "universelle" pour les produits touchant au domaine pharmaceutique.