Chromatographie d'affinité
La chromatographie d'affinité est une technique de chromatographie qui permet de séparer un composé en utilisant des interactions biologiques entre un ligand spécifique (greffé sur une matrice macromoléculaire) et son substrat, en l'occurrence la molécule à isoler. Sa principale application industrielle est la purification des anticorps monoclonaux.
Principe
Comme toutes les chromatographies, la chromatographie d'affinité permet de séparer les composants d'un mélange, donc de purifier les substances. Pour cela, elle utilise les propriétés d'interactions biologiques, donc elle peut purifier un composant en une seule étape. Une matrice insoluble à laquelle est attaché un ligand spécifique de la molécule à purifier et se liant de manière réversible avec celle-ci est utilisée.
Molécule à purifier + ligand spécifique-matrice insoluble ↔ Molécule-ligand-matrice insoluble
La molécule d'intérêt se fixe donc à la matrice et les autres composants sont élués. Puis on détache celle-ci de la matrice, ainsi la molécule est purifiée. Pour pouvoir séparer des composants par cette méthode, il faut donc connaître la structure et la spécificité de la molécule d'intérêt afin de choisir un bon ligand, c'est-à-dire que le ligand ne doit pas accrocher d'autres composés que la molécule.
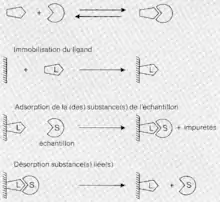
Méthodologie
Couplage du ligand
Pour cela, il faut coupler le ligand sur une résine à chromatographie qui, en tant que telle, n'a pas d'affinité pour la molécule d'intérêt. Ce couplage doit évidemment se faire sans dénaturer le ligand pour que ce dernier conserve son affinité avec la molécule d'intérêt.
Il existe sur le marché des gels de couplage qui sont des résines préparées à l'avance sur lesquelles est couplé le ligand choisi. Ce sont des résines spécialisées destinées uniquement à cet usage. Elles possèdent en général un groupement chimique facilement activable posé au bout d'un bras écarteur. Diverses résines existent avec divers groupements activables selon la nature chimique du ligand qu'on veut utiliser.
Ce couplage consiste donc à "activer" la résine pour qu'elle puisse former un lien covalent avec le ligand, puis à mettre le ligand en présence de la résine. Il y a ensuite déclenchement de la réaction de formation d'une liaison covalente entre le ligand et la résine afin d'éviter que celui-ci ne se détache et empêche la fixation de la molécule d'intérêt. Enfin, les réactifs résiduels sont éliminés en percolant le gel avec un tampon approprié.
Adsorption
L'adsorption consiste à mettre en présence le mélange contenant la molécule d'intérêt et le ligand fixé à la résine dans des conditions favorables à la liaison ligand-molécule spécifique. Les molécules n'ayant pas d'affinité pour le ligand ne se fixeront pas sur la résine et seront éluées, tandis que celles ayant une affinité y resteront attachées.
Désorption
La désorption est pratiquée pour récupérer la molécule d'intérêt fixée à la résine lorsque les autres molécules du mélange sont éluées. Pour cela, le complexe molécule d'intérêt-résine est exposé dans des conditions où l'interaction ligand-molécule spécifique est moins stable.
Méthode sur colonne
C'est la méthode la plus commune pour adsorber les molécules d'intérêt.
Le mélange ainsi que le solvant servant de phase mobile sont introduits dans la colonne de résine à laquelle le ligand spécifique de la molécule a été préalablement fixé. Donc la molécule d'intérêt reste dans la colonne alors que le reste sort par gravité et flux de solvant. Ensuite, la molécule liée à la résine est éluée en percolant un solvant déstabilisant l'interaction ligand-molécule spécifique pour recueillir celle-ci.
Méthode en cuve agitée (ou réacteur agité)
La méthode consiste à exposer la résine et le mélange à séparer simplement en les brassant ensemble, par exemple dans un bécher avec un agitateur magnétique, durant une période de temps suffisante pour que l'adsorption complète se fasse.
La résine est récupérée, sur laquelle les molécules d'intérêt sont toujours attachées, par simple sédimentation ou, quelquefois, par centrifugation ou filtration pour accélérer le processus. Le "surnageant" ou le "filtrat" contenant le matériel non adsorbé est éliminé, puis la résine est lavée avec le solvant d'adsorption pour enlever les traces résiduelles de contaminants. La molécule d'intérêt peut alors être désorbée, avec un solvant déstabilisant l'interaction ligand-molécule spécifique.
Cette méthode n'est quasiment plus utilisée à l'échelle industrielle, car elle est moins efficace que la colonne et nécessite de manipuler la phase solide, notamment d la filtrer. On utilise maintenant la méthode en colonne, désignée par chromatographie préparative.
Détection des effluents
Les effluents caractérisent le solvant, les analytes c'est-à-dire les constituants de l'échantillon qui doivent être caractérisés. Si la colonne est employée pour effectuer la chromatographie d'affinité, il faut suivre alors au fur et à mesure la sortie de la molécule d'intérêt après désorption.
Si la molécule d'intérêt est une protéine, alors l'identification est basée sur le fait que les protéines absorbent dans l'UV et si celles-ci contiennent un acide aminé aromatique comme la tyrosine, phénylalanine et tryptophane, alors un pic d'absorption vers 280 nm peut être observé. C'est pourquoi la quantification des protéines se fait par spectrophotométrie d'absorption à 280 nm.
Si la molécule d'intérêt est un acide nucléique, alors le pic d'absorption se situe vers 254 nm.
Types de chromatographie d'affinité
Chromatographie d'affinité avec protéine comme ligand
La chromatographie d'affinité avec la protéine A (et aussi G et L) comme ligand est une application industrielle pour la purification des anticorps monoclonaux.
Les anticorps ont des affinités pour les parois cellulaires des bactéries, ce qui est la raison de leur efficacité. On utilise ainsi les protéines A, G et L qui sont des parties de la paroi cellulaire de bactéries Staphylococcus aureus et streptocoque. Leur masse molaire est d'environ 50 000 g/mol. Elles ont une forte affinité pour le fragment Fc des anticorps polyclonaux ou monoclonaux type IgG. C’est la base de la purification des IgG: on greffe ces protéines (recombinantes d'E.Coli) sur un support poreux en billes (gel d'agarose ou résine de polystyrène-divinylbenzène), ce qui permet d'obtenir un grand nombre de sites de fixation par unité de volume (et par conséquent de diminuer la taille des installations). La protéine A se lie fortement aux IgG1, 2 et 4. Elle ne se lie pas ou peu aux autres Ig (IgG3, IgA, IgD, IgE, IgM). La protéine G fixe plus de types d’Ig que la protéine A et exclut l’albumine. La protéine L se lie à la partie kappa variable des chaînes légères (L, d'où son nom) des Ig ou de leurs fragments.
La protéine A peut fixer deux molécules d’IgG.
La fixation s'effectue à pH >6, par exemple dans un tampon phosphate de sodium 0,02 M de pH 7,0. L'élution s'effectue de pH 3 à pH 6, par exemple dans un tampon acide citrique 0,1 M de pH 3,0. Une molécule qui est utilisée comme ligand est l'héparine. Elle est utilisée dans la purification des facteurs de croissance et de coagulation (antithrombine III), récepteurs stéroïdiens, endonucléases, lipases. L'affinité est moyenne et l'élution s'effectue par augmentation de la force ionique.
La mise en œuvre est réalisée dans des colonnes où le lit de billes est typiquement d'une hauteur de 30 cm et d'un diamètre pouvant aller jusqu'à un mètre. Les billes ont un diamètre de 50-100 microns. L'étape de chromatographie d'affinité dans le procédé complet d'extraction et de purification est en général suivie de deux étapes de purification par chromatographie d'échange d'ions. Il y a ensuite une filtration virale et une ultrafiltration de formulation.
Chromatographie sur colorant
Cette technique est aussi appelée chromatographie de pseudo-affinité. Un des colorants utilisés est le bleu de Cibacron.
Il a été démontré que des enzymes se fixent sur le bleu de Cibacron, notamment les déshydrogénases à coenzyme NAD+ de par la ressemblance structurale avec le NAD+ . Donc ce colorant se comporte comme un analogue structurel de l'ADP, l'AMP, l'ATP et le GTP, ce qui lui permet de retenir des protéines liant des nucléotides. Mais il n'est pas spécifique d'une protéine ce qui ne fait pas un bon ligand pour séparer des protéines liant les nucléotides.
Donc la chromatographie sur colorant ne permet pas de retenir la molécule d'intérêt, mais les composants que le colorant reconnaît, c'est pourquoi cette technique est qualifiée de pseudo affinité.
Cette technique est néanmoins beaucoup utilisée car, même si la molécule d'intérêt n'est pas liée spécifiquement, celle-ci est colorée donc plus pratique à manipuler. Pour séparer la molécule d'intérêt aux autres composants que le colorant reconnait s'ils sont présents dans le mélange, il faut effectuer une autre chromatographie d'affinité avec un ligand spécifique.
Chromatographie covalente
Cette chromatographie permet de retenir des analytes contenant des groupes thiols en formant des ponts disulfure.
Chélation de métaux immobilisés
La chelation de métaux immobilisés permet de séparer et d'étudier la structure de protéines ayant une affinité pour les ions de métaux lourds.
Appareillage
Effecteurs
Les effecteurs sont des ligands qui fixent toutes substances capables de former des complexes stables avec des molécules à isoler. Ces substances doivent posséder un groupement réactif assez éloigné du site actif pour que celui-ci reste librement accessible après la fixation.
Chaque domaine possède des effecteurs précis ; c’est pourquoi pour la purification d’enzymes, il est préférable de choisir des substrats et analogues de substrats, des inhibiteurs réversibles, des effecteurs allostériques et des coenzymes. En immunologie, les haptènes, les anticorps et les antigènes sont les mieux adaptés. Et, enfin, pour les protéines réceptrices, des hormones, des peptides et des analogues de peptides sont utilisés.
Supports
Les propriétés d’un support sont :
- être insoluble dans l’eau mais mouillable
- être poreux
- être stable chimiquement et mécaniquement
- porter un groupement fonctionnel réactif permettant la fixation des « spacer » (bras fixateur)
Il y a différentes sortes de supports à partir de dérivés de polymères osidiques :
- la carboxyméthylcellulose : dans ce dérivé plusieurs sortes de carboxyméthylcelluloses comme la CM-cellulose aminohexylique possèdent un « spacer » (bras espaceur) long permettant d’avoir une certaine distance entre le ligand et le support ce qui réduit la contrainte stérique et facilite la réaction de complexation. Puis, à l’inverse, la CM-cellulose hydrazide qui possède un « spacer » court permettant la fixation d’effecteur ayant une masse molaire élevée. Ces deux dérivés permettent la fixation d’effecteurs portant une fonction carboxyle.
La CM-aminohexylique succinylée et la CM-cellulose aminododécylique sont des supports permettant la fixation des effecteurs portant une fonction –NH2 réactive.
- les sépharoses activées
- le gel de polyacrylamides
Facteurs influençant la complexation ligand/molécule d'intérêt
Le tampon additionné de substance où le gel est mis en suspension permet de protéger la liaison entre le ligand et le support.
La dimension de la colonne et le volume du lit de gel sont adaptés à la quantité d’échantillon à traiter et à la capacité de rétention du gel.
Le tampon a un pH, une force ionique et une composition définis pour pouvoir réaliser la réaction de complexation. En effet le pH est choisi de façon qu’il n’y ait pas de dénaturation de la protéine et que la stabilité du complexe entre effecteur et partenaire soit au maximum. De plus, le pH et la force ionique sont aussi prédéfinis pour éviter une interaction entre le support et les partenaires d’affinités.
La température quant à elle, joue un rôle dans la durée de la complexation ; plus la température est basse, plus le temps de complexation sera long.
Applications
La chromatographie d’affinité a été utilisée :
- en enzymologie, pour l’extraction d’enzymes et la purification d’extraits enzymatiques ;
- en immunologie, pour la purification d’anticorps ;
- en biochimie, pour l’isolement des protéines et des acides nucléiques.
Isolement des protéines et des antigènes
Pour isoler des protéines de nombreuses sortes de molécules peuvent être utilisées comme ligand.
Les anticorps sont des ligands très efficaces pour isoler leur antigène spécifique, il s'agit de l'immunoaffinité. L'interaction entre un antigène et son anticorps est très forte, les constantes de dissociation (Kd) de l'ordre 10−10M ne sont pas rares. Le défi dans ces chromatographies est de détacher l'antigène sans l'endommager et, si possible, sans endommager la colonne et l'anticorps qui lui est attaché. Il faut donc employer des conditions douces de détergents (Triton, Tween).
Les ligands d'une enzyme peuvent être un cofacteur non hydrolysable de cette enzyme, ou encore un analogue structurel non hydrolysable du substrat.
De plus, certains colorants ont une affinité inattendue pour certaines protéines. Ainsi, le bleu de dextran peut se fixer de façon réversible à certaines kinases tandis que le bleu de procion a une affinité pour des déshydrogénases utilisant le NAD comme cofacteur.
Isolement d'acides nucléiques
Les ARNm polyadénylés peuvent facilement être isolés par chromatographie sur des résine d'oligo(dT)-cellulose ou de poly(U)-Sepharose. En effet, à forte force ionique, la courte séquence de polyadénines au bout 3' des ARNm peut se lier par simple complémentarité de base à des séquences de d'oligo-désoxythymidine ou de poly-uridine. Il faut ensuite désorber à faible force ionique.