Batterie redox vanadium
Une batterie redox vanadium (ou batterie à oxydoréduction au vanadium) est un type de batterie rechargeable à flux qui utilise le vanadium dans différents états d'oxydation pour stocker l'énergie potentielle chimique. Un brevet allemand de batterie à flux au chlorure de titane avait déjà été enregistré et accepté en 1954, mais la plupart des développements ont été réalisés par les chercheurs de la NASA dans les années 1970.
| Batterie vanadium redox | |
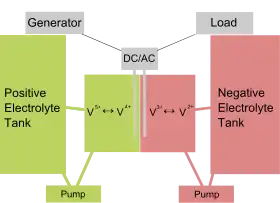 Schéma d'une batterie redox vanadium | |
| Caractéristiques | |
|---|---|
| Énergie/Poids | 10 à 20 Wh/kg |
| Énergie/Volume | 15 à 25 Wh/ℓ |
| Rendement charge-décharge | 75-80 % |
| Durée de vie | 10-20 ans |
| Nombre de cycles de charge | >10 000 cycles |
| Tension nominale par élément | 1,15-1,55 V |
L'utilisation du vanadium avait déjà été suggérée, mais la première démonstration réelle et le développement commercial de toutes les batteries vanadium à flux travaillant avec une solution d'acide sulfurique ont été réalisés par Maria Skyllas-Kazacos et collaborateurs à l'université de Nouvelle-Galles du Sud en Australie.
La forme actuelle (électrolytes à l'acide sulfurique) a été brevetée par l'université de Nouvelle-Galles du Sud en 1989[1].
Principe
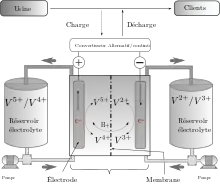
Les batteries à flux stockent l'électricité et la génèrent par réaction d'oxydoréduction. Elles présentent deux compartiments (cellules de puissance) séparés par une membrane échangeuse de protons, où sont plongés des collecteurs de courant (électrodes). Cette membrane permet l'échange de protons entre les deux compartiments anodique et cathodique, où les solutions électrolytiques sont susceptibles d'être réduites et oxydées.
Les deux électrolytes liquides sont basés sur le vanadium :
- la demi cellule positive contient des ions VO2+ et VO2+ ;
- la demi cellule négative contient des ions V3+ et V2+.
Les électrolytes peuvent être préparés par différents procédés. Par exemple, du pentoxyde de vanadium (V2O5) peut être dissous dans l'acide sulfurique (H2SO4), donnant une solution fortement acide.
Le vanadium existant dans 4 états d'oxydation, des batteries avec un seul élément électroactif, au lieu de deux, peuvent être fabriquées.
Principaux avantages
Les principaux avantages de cette technique sont :
- capacité modulable à volonté, en utilisant des réservoirs plus ou moins grands, plus ou moins remplis ;
- la batterie peut être laissée déchargée pendant de longues périodes sans se dégrader. Elle peut aussi être rechargée en remplaçant l'électrolyte si aucune source d'énergie n'est disponible pour la charger. Cette batterie permet ainsi un rechargement rapide par remplacement de l'électrolyte grâce à une pompe, ou un rechargement lent, par branchement à une source d'énergie ;
- si les électrolytes sont mélangés accidentellement, la batterie ne souffre d'aucun dommage irréversible.
Principaux désavantages
Les inconvénients sont :
- la densité massique d'énergie est relativement faible, elle se situe entre 15 et 25 Wh/kg[2] ;
- plus complexe que les batteries standards.
Applications
La capacité importante de ces batteries les rend bien adaptées aux applications nécessitant des stockages importants, une réponse à un pic de consommation, ou un lissage de la production de sources variables comme les centrales solaires ou éoliennes.
La faible autodécharge et la maintenance limitée ont mené à leur adoption dans certaines applications militaires[3].
Ces batteries permettant de répondre rapidement à la demande, elles peuvent aussi être employées dans les applications ASI (alimentation sans interruption) où elles remplacent les batteries plomb-acide ou les groupes électrogènes.
Références
- (en)M. Skyllas-Kazacos, M. Rychcik and R. Robins, in AU Patent 575247 (1986), to Unisearch Ltd.
- (en) Kyle Lourenssen, James Williams, Faraz Ahmadpour et Ryan Clemmer, « Vanadium redox flow batteries: A comprehensive review », Journal of Energy Storage, vol. 25, , p. 100844 (DOI 10.1016/j.est.2019.100844, lire en ligne, consulté le )
- [PDF]Page 18 : Batteries redox: généralités, sur fondation-tuck.fr, consulté le 28 janvier 2019