Assimilation génétique
L’assimilation génétique est un processus par lequel un phénotype (état de caractère observable), originellement induit en réponse à des conditions environnementales particulières, devient encodé, après plusieurs générations, dans le génome (le génotype) par sélection naturelle ou sélection artificielle. Le nouveau phénotype, apparu en réponse à un signal environnemental, devient « constitutif », c’est-à-dire qu’il apparaît sans l’influence préalable du déclencheur initial[1]. Cette théorie évolutionnaire a été proposée en 1953 par le biologiste du développement et généticien Conrad Hal Waddington.
En d’autres termes, le phénotype devient assimilé dans la séquence d'ADN lorsqu’il atteint le seuil où il devient indépendant de l'influence de la condition originale l'ayant créé[2].
Malgré les apparences, ce processus n’est pas lamarckien ; c’est-à-dire qu’il ne prouve pas l’hérédité des caractères acquis proposée par Lamarck. La théorie de Lamarck propose en effet que des individus, au cours de leur vie, s’adaptent à leur environnement et que ces adaptations acquises deviennent héréditaires.

Ce que Waddington propose pour sa part, c’est qu’il existe des génotypes plus sensibles que d’autres à changer de trajectoire développementale en réponse à certaines conditions environnementales. Cette sensibilité reflète une plus faible résistance aux mutagènes, ce qui entraîne un taux de mutations au niveau du génome plus élevé que la normale. Cette sensibilité, à long terme, peut devenir héréditaire[1].
Cependant, il est à remarquer que ces caractères acquis devenus héréditaires sont le fruit de perturbations environnementales au moment du développement et non pendant la vie adulte de l’organisme. C’est donc seulement à ce moment qu’un caractère « acquis » pourrait devenir héréditaire et que l’assimilation génétique pourrait survenir.
Plasticité phénotypique
La plasticité phénotypique est définie comme étant la propriété d’un génotype à produire différents phénotypes lorsqu'il est exposé à différentes conditions environnementales. Ce procédé augmente de façon considérable les chances de survie d'un organisme dit « plastique », puisqu'il peut s’adapter à une plus grande variation de changements environnementaux. Les différents phénotypes plastiques ne sont pas héréditaires, mais la capacité d’être plastique l’est[3].
Expériences de Waddington
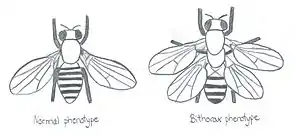
Pour prouver sa théorie, Waddington a exposé des œufs de drosophiles à un mutagène, la vapeur d’éther. Cette perturbation chimique a entraîné l’apparition d’un phénotype mutant bithorax dans une faible proportion de la population étudiée. Cette mutation homéotique provoque la transformation du troisième segment thoracique de la drosophile qui produit normalement des haltères (petites structures servant à équilibrer le vol des diptères), en une répétition du deuxième segment qui, quant à lui, produit des ailes. Waddington a ensuite reproduit entre elles uniquement les drosophiles ayant subi ce changement. En d’autres mots, il a croisé entre eux les spécimens ayant réagi au mutagène, donc qui sont les plus susceptibles de changer de patron de développement en réponse à ce stimulus externe. Après plusieurs générations, en sélectionnant artificiellement les génotypes les plus sensibles, Waddington a réussi à produire des phénotypes bithorax sans traitement préalable à la vapeur d’éther[4]. Ce qui veut donc dire que ce phénotype s’est encodé dans le génome. C’est ce qu’on appelle l’assimilation génétique.
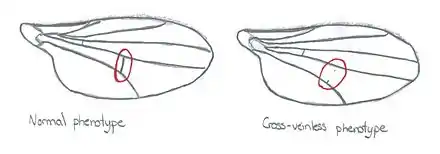
Waddington a refait une expérience similaire en exposant des œufs de drosophiles à des chocs thermiques (au lieu de la vapeur d’éther). Cette perturbation externe a causé l'apparition de drosophiles avec des ailes sans veines transversales (cross-veinless). En sélectionnant seulement les drosophiles qui ont subi ce changement et en les reproduisant entre elles, après plusieurs générations, le phénotype apparaît sans le choc thermique appliqué préalablement sur les œufs. Ainsi, un phénotype originellement induit par un stimulus peut devenir héréditaire par assimilation génétique[1].
Cependant, il n’y a aucune raison de croire que le phénotype avec ailes sans veine transversale (cross-veinless) est plus adapté à la chaleur, ou que le phénotype bithorax est plus adapté pour survivre à la vapeur d’éther que le phénotype sauvage, puisque ceux-ci ont été sélectionnés de façon artificielle[1]. Il est probable que dans ces deux expériences, les perturbations induites ont créé plusieurs types de mutations, mais qu’on a arbitrairement sélectionné les mutants cross-veinless et bithorax. Dans la nature, ces phénotypes ne se seraient pas propagés de manière significative, puisque ces assimilations n’avaient pas une origine dite adaptative mais plutôt artificielle. Par contre, il est possible qu'une assimilation génétique d'un phénotype avantageux puisse se propager dans la nature face à de nouvelles conditions environnementales.
Paysage épigénétique et canalisation
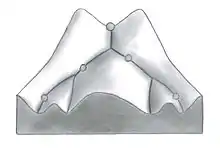
Waddington utilise la métaphore « paysage épigénétique » pour représenter les différents parcours possibles lors du développement d’un organisme. Il illustre cela sous forme de différents chemins possibles que peut emprunter une balle (représentant l’organisme), selon le relief du paysage. Il utilise le terme de « canalisation » pour désigner la stabilité locale de la trajectoire. La canalisation est la mesure de la capacité d’une population à garder le même phénotype par rapport aux variations de son environnement ou aux variations de son génotype. Le terme robustness est aussi beaucoup utilisé pour désigner la profondeur de la canalisation, c’est-à-dire la force d’un phénotype à ne pas changer malgré les influences extérieures (épigénétique). Certains phénotypes peuvent être à la fois très robustes face à certaines perturbations et très sensibles à d’autres. C’est la façon abstraite de Waddington pour expliquer le fait que les systèmes de développement sont jusqu’à une certaine limite résistants aux perturbations génétiques et environnementales. Cependant, certaines perturbations sont trop extrêmes pour garder le même chemin développemental. Le développement prend alors une trajectoire différente et il change de patron de développement, ce qui produit un changement phénotypique permanent, c'est-à-dire gravé dans le génome[4] - [5].
Selon Waddington, sous l’influence de la sélection naturelle, le développement tend à devenir canalisé afin que les organes et les tissus soient produits de façon normale, même si des anormalités génétiques ou environnementales surviennent[1].
Dans le cas de l'assimilation génétique, le chemin de la canalisation se déplace graduellement (de génération en génération) jusqu’à devenir un nouveau chemin en soi, détaché de l’ancien chemin qui donnait l’ancien phénotype. Une fois ce nouveau chemin bien établi, il devient utilisé même si les conditions initiales ne sont plus remplies.
L’explication génétique est que les allèles ayant une plus grande tendance à produire le patron modifié de développement ont été progressivement accumulés, à travers les générations, par le processus de sélection.
Effet des perturbations environnementales
Il a été démontré dans plusieurs études qu’un environnement anormal (stressful environnement) augmente la variation phénotypique et génotypique d’une population, en perturbant l'homéostasie et la canalisation du patron de développement. Le stress induit par ces perturbations augmente le taux de mutations, de recombinaisons et de transpositions des gènes[6]. Le stress altère également la régulation des protéines chaperons, qui ont pour fonction de limiter l’expression de la variation génétique[6].
Lors de perturbations environnementales, il est avantageux pour une population d’avoir un large éventail de variations phénotypiques afin d’avoir plus de chance qu’un ou plusieurs de ces phénotypes survivent à ces changements environnementaux, et ainsi de réduire les risques d’extinction. Il est donc bénéfique pour une espèce d’avoir la capacité de répondre à un stress environnemental (concept de sensibilité). Les perturbations environnementales imposent une sélection directionnelle par une forte pression de sélection. De façon générale, les nouveautés évolutives apparaissent en raison d’une perturbation environnementale, car celle-ci donne l’occasion de propager ce nouveau trait s’il est avantageux.
Rôle dans la sélection naturelle
Jusqu’à récemment, même si l’assimilation génétique avait été prouvée à maintes reprises par des expériences, les chercheurs n’en avaient pas trouvé d’exemples dans la nature et ne pouvaient prouver qu'elle se produisait réellement dans l’évolution naturelle[3]. Cependant, des modélisations mathématiques suggèrent que, sous certaines circonstances, la sélection naturelle favorise un génotype sensible aux conditions extrêmes. Si le résultat d’une telle défaillance, c’est-à-dire le nouveau phénotype, est favorisé par la sélection naturelle, l’assimilation se produira[5].

En 2009, des chercheurs ont démontré que l’évolution de la taille de la tête des serpents-tigres est due à une assimilation génétique. Ces serpents-tigres se trouvent en Australie et sur les îles australiennes. Ces chercheurs ont étudié deux types de populations de serpents sur les îles australiennes : les populations récentes introduites par l’activité humaine il y a environ une trentaine d’années et les populations résidentes à long terme, qui ont quitté le continent australien il y a environ 9 000 ans. Ils ont démontré que les jeunes populations de serpents-tigres avaient la capacité de modifier la taille de leur tête selon la taille des proies ingérées lors de leur croissance, ce qui constitue une plasticité phénotypique en soi. Puis, ils ont remarqué que les plus vieilles populations résidentes n’ont plus cette plasticité. En effet, les vieilles populations ont une grande tête dès la naissance, quelle que soit la taille des proies ingérées lors de leur développement. On a appelé ce phénomène l’érosion post-coloniale de la plasticité phénotypique[7], puisque le niveau de plasticité diminue de génération en génération[8]. L’assimilation génétique est donc bien un phénomène naturel.
On peut expliquer ce phénomène par le fait que sur le continent, les conditions environnementales sont très variables. Les espèces de serpents continentales doivent donc avoir la capacité à s’adapter à des conditions différentes. Sur les îles, l’environnement est beaucoup plus stable et les ressources sont plus constantes. Ainsi, la plasticité n’est plus aussi avantageuse sur les îles que sur le continent. À long terme les serpents-tigres vivant sur les îles ont donc perdu de façon progressive leur plasticité phénotypique.
La plasticité phénotypique est bénéfique pour les organismes vivant dans un environnement hétérogène, alors que l’assimilation génétique (perte de la plasticité) est plus bénéfique dans un environnement homogène[8]. La plasticité a des coûts considérables tels que les coûts énergétiques associés au maintien de mécanismes sensoriels et régulateurs, les coûts associés à la production de différents phénotypes, un développement instable et un coût génétique face à des mutations désavantageuses. Ainsi, si la plasticité n’est pas nécessaire, elle a tendance à disparaître.

Relya (2002)[8], a par exemple étudié le coût de la plasticité morphologique chez les têtards de grenouilles des bois (Rana sylvatica) en réponse aux insectes prédateurs. Il a été démontré qu’en présence de prédateurs, il y a une augmentation de la plasticité sur plusieurs traits morphologiques qui ont des effets négatifs sur leur croissance et leur développement, mais que le taux de survie était accru avec l’intensité de la plasticité. En l’absence de prédateurs cependant, le taux de survie diminuait avec l’intensité de la plasticité. Ainsi, les environnements stables favorisent la canalisation du développement afin de limiter la plasticité phénotypique[8].
Notes et références
- (en) Waddington, C.H. 1953. Genetic assimilation of an acquired character. Evolution 7, 118-126.
- Masel, J. 2004. Genetic assimilation can occur in the absence of selection for the assimilating phenotype, suggesting a role for the canalization heuristic. Journal of Experimental Biology, 17, pg.1106-1110. 10.1111/j.1420-9101.2004.00739.
- Pigliucci, M., Murren, C.J. & Schlichting, C.D. 2006. Phenotypic plasticity and evolution by genetic assimilationThe Journal of Experimental Biology, 209, 2362-2367. 10.1242/jeb.02070
- Waddington, C.H. 1942. Canalization of development and the inherence of acquired characters. Nature, 150, 563
- Eshel, I. & Matessi, C. 1998. Canalization, genetic assimilation and preadaptation : A quantitative genetic model. Genetics, 149 (4): 2119–33.
- Badyaev, A.V. 2005. Stress-induced variation in evolution: from behavioural plasticity to genetic assimilation. Proceeding of the Royal Society B, 272 (1566), pg. 877-886. 10.1098/rspb.2004.3045
- Aubret, F. & Shine, R. 2009. Genetic assimilation and the post-colonization erosion of phenotypic plasticity in island tiger snakes. Current Biology, 19 (22), pg.1932-1936. 10.1016/j.cub.2009.09.061
- Crispo, E. 2007. The Baldwin effect and genetic assimilation: Revising two mechanisms of evolutionary change mediates by phenotypic plasticity. Evolution 61-11: 2469-2479. 10.1111/j.1558-5646.2007.00203
Voir aussi
Liens externes
- (en) Big-headed tiger snakes support long-neglected theory of genetic assimilation, Ed Vong, Discover,
- Épigénétique et métabolisme, András Páldi, dossier de Pour la Science sur le paysage épigénétique, octobre-.