Apavac
Avapac est un procédé utilisé en cancérologie. Les cellules cancéreuses produisent de nombreuses protéines anormales. Cette production varie dans l'espace et dans le temps. Le procédé Apavac permet de purifier certaines protéines anormales à partir d'une biopsie tumorale et les associer ensuite à un adjuvant afin de stimuler le système immunitaire du patient contre les cellules cancéreuses.
Vaccin thérapeutique antitumoral autologue. Procédé Apavac
Il y longtemps qu’il a été établi que le système immunitaire avait un rôle majeur dans le contrôle du processus tumoral. Divers procédés ont été élaborés pour stimuler le système immunitaire contre des cellules anormales dont la purification de protéines anormales autologues synthétisées par les cellules tumorales. L’association de ces protéines avec un adjuvant permet d’obtenir un effet antitumoral utilisable en clinique vétérinaire et humaine.
Une vaccination autologue thérapeutique contre une tumeur est basée sur l'extrême instabilité génétique dans l'espace et dans le temps des cellules tumorales[1] - [2]. Les tumeurs cancéreuses synthétisent plusieurs dizaines à plusieurs centaines de protéines anormales au cours de leur évolution[3]. Ces synthèses évoluent dans le temps au fur et à mesure des modifications de la génétique des cellules tumorales et dans l’espace en fonction de l’apparition et la disparition de clones ayant des synthèses différentes à des endroits différents de la tumeur ou dans des métastases. Ces protéines ont une signature immunogénique faible et de plus des mécanismes d’échappement au système immunitaire apparaissent lors du développement de la tumeur[4].Ce sont les raisons générales pour lesquelles les tumeurs cancéreuses échappent au système immunitaire, alors qu'il a été reconnu que des cellules anormales sont éliminées quasi quotidiennement au fur et à mesure de leur apparition.
La stratégie d’une vaccination par protéine autologue consiste à mettre sous forme visible par le système immunitaire les protéines anormales synthétisées par la tumeur et qui ne sont pas identifiées dans la tumeur par le système immunitaire. Pour une question d’efficacité, il est préférable d’utiliser le plus grand nombre de protéines possible. En effet, pour obtenir une réaction immunitaire contre un antigène, il faut qu’il soit présent et la probabilité qu’un groupe de protéines disparaisse lors de l’apparition d’un nouveau clone est inversement proportionnel au nombre de protéines de ce groupe. D’autre part la fabrication d’un vaccin autologue contenant de nombreuses protéines permet de s’adapter à l’évolution des synthèses tumorales dans le temps, simplement en refaisant un vaccin à partir d’une nouvelle biopsie.
Mécanisme d’action
Le procédé APAVAC consiste à purifier les protéines autologues anormales d’une tumeur et en particulier les protéines du choc thermique sur une colonne d’hydroxyapatite[5]. Des protéines tumorales cytoplasmiques extraites par précipitation sont passées à travers une colonne de poudre d’hydroxyapatite. Les protéines purifiées sont des protéines du choc thermique (HSPs), celles-ci sont synthétisées en grande quantité dans de nombreuses tumeurs cancéreuses. Ces protéines chaperonnent les protéines et peptides cellulaires en cas de stress chimiques et/ou physiques et stabilisent la structure de ces derniers. Elles ont de plus un rôle essentiel dans la mise en forme des protéines et peptides associées et leur présentation aux lymphocytes T à la surface des cellules présentatrices de l'antigène. En purifiant les principales HSPs à partir de la tumeur on obtient ainsi une empreinte digitale des synthèses cellulaires à la fois normales et anormales. La poudre d’hydroxyapatite chargée en protéines est ensuite réinjectée en sous-cutané ou intradermique suivant une séquence déterminée pendant une période longue afin de permettre au système immunitaire de contrôler la croissance tumorale.
Les protéines du choc thermique en particulier les gp96 et HSP70 ont un rôle particulier dans la présentation de l’antigène et le cross-priming des CD8 par les cellules dendritiques qui sont des cellules présentatrices de l'antigène (CPAs). Ces dernières ont des récepteurs spécifiques (cd91) pour ces protéines du choc thermique et permettent de mettre en forme au niveau de protéines du CMH de type I les peptides qui leur sont associés et qu’elles chaperonnent [6] - [7]. Elles permettent de ce fait l’activation des cd8 lorsque les peptides ne sont pas reconnus comme des peptides normaux ce qui est fréquent avec les cellules tumorales. Il faut enfin souligner que de très nombreux cancer, pour des raisons variées, surexpriment les HSPs[8] - [9]. Dans le cadre de la présentation antigénique, les HSPs ont un plus un rôle d’adjuvant en faisant synthétiser aux APCs diverses cytokines et facteurs de croissance intervenant dans la réaction immunitaire.
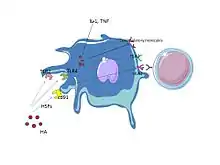
Les particules d’HA qui sont utilisées dans la purification ne sont pas seulement des vecteurs. Elles ont aussi une capacité à stimuler l’inflammasome (NLRP3)[10], elles induisent de plus la maturation des cellules dendritiques (expression des CD40, 83 et 86) amplifiant l’effet adjuvant des HSPs. Injectées en sous-cutané, les particules d'HA provoquent une réaction à corps étranger (fig.1) mettant ainsi les protéines portées par les particules d'HA au contact des cellules présentatrices de l'antigène. Elles ont de plus la capacité à vectoriser des molécules adsorbées à leur surface à l'intérieur des cellules (fig. 2). Ceci a été démontré par leur capacité à transfecter de manière stable des gènes à la fois in vitro[11] et in vivo[12] en particulier dans les cellules monocytaires.
Applications
Tumeurs cancéreuses synthétisant des HSPs[13] à un stade précoce en association avec la chimiothérapie et la chirurgie. En ce qui concerne les tumeurs solides, il est nécessaire de réduire le volume tumoral afin que les cellules lymphocytaires aient accès aux cellules tumorales. D’autre part le système immunitaire doit être fonctionnel, et lors d’administration concomitante avec la chimiothérapie, une fenêtre thérapeutique dans la chimiothérapie doit être aménagée afin de permettre au système immunitaire d’être fonctionnel durant la vaccination.
Apavac est utilisé en médecine vétérinaire chez le chien pour les lymphomes B (DLBCL), les ostéosarcomes, les carcinomes épidermoïdes, les tumeurs mammaires, les mélanomes, les mastocytomes, les angiosarcomes. Chez le cheval APAVAC a été utilisé pour le mélanome du cheval blanc. Chez le chat APAVAC a été utilisé pour le fibrosarcome du chat.
La technologie étant transversale (personnalisée), d’autres applications sont envisageables.
Effets secondaires
Aucun effet secondaire systémique n’a été constaté. Des effets locaux(érythème) localisés ont pu être observés.
Médecine vétérinaire
Une étude en double aveugle sur le lymphomes (B) de haut grade du chien a montré une amélioration de la survie des chiens traités par un protocole chimiothérapique (CHOP)/apavac par rapport par rapport à un protocole CHOP seul ainsi que leur TTP[14] (time to progression). Il semble également qu’un vaccin peut être refait lors de reprise de la tumeur et dans ce cas, le TTP est également augmenté. Des chiens (20%) sont toujours vivants à trois ans sans aucun traitement.
Apavac a montré être actif sur les ostéosarcomes du chien puisque sur les grades inférieurs à IIb ont une survie supérieure à huit mois sans chimiothérapie ce qui est bien supérieur à tout ce qui a été publié avec des protocoles de chimiothérapie
Médecine humaine
Une étude de phase I a démontré chez des patients[15] atteints de divers types de tumeurs que le protocole de vaccination ne provoque pas d'effets secondaires ni au niveau local ni au niveau systémique.
Notes et références
- Ard, P.L., Hansen, A.R., Ratain, M.J., Siu, L.L, Tumour heterogeneity in the clinic. Nature (2013), 501: 155, 164
- Aanton, C., Intratumor heterogeneity: evolution through space and time. Cancer Res (2012), 72: 4875-4882
- gg rini, S., Gorgoulis, V.G., Halazonetis, T.D., Genomic instability - An evolving hall mark of cancer. Nature Reviews. Molecular Cell Biology. (2010), 11; 210-228.
- Töpfer, K., Kempe, S., Müller, N., Schmitz, M., Bachmann, M., Cartellieri, M., Schackert, G., Temme, A., Tumor Evasion from T Cell Surveillance. Journal of Biomedicine and Biotechnology (2011). ID 918471,
- Frayssinet Patrick, Cuello-Carion, D., Laquerrière, P., Grandjean-Laquerièrre, A., Ciocca, D., Autovaccination against tumors using a mineral/protein composite. In Radons, J., Multhoff, G., (eds) Heat Shock Proteins in Biology and Medicine, Reasearch Signpost, Kerala 2006
- Oizumi, S., Strbo, N., Pahwa, S., Deyev, V., Podack, E.R., Molecular and Cellular Requirements for Enhanced Antigen Cross-Presentation to CD8 Cytotoxic T Lymphocytes, The Journal of Immunology (2007), 179 : 2310-2317
- Pawaria, S., Binder, R.J., CD91-dependent programming of T-helper cell responses following heat shock protein immunization. NATURE COMMUNICATIONS | 2:521 | DOI: 10.1038/ncomms1524 | http://www.nature.com/naturecommunications
- Romanucci, M., D’Amato, G., Malatesta, D., Bongiovanni, L., Palmieri, C., Ciccarelli, C., Buracco, P., Morello, E., Maniscalco, L., De Maria, R., Martano, M., Della Salda, L., Heat shock protein expression in canine osteosarcoma Cell Stress and Chaperones (2012) 17:131–138
- Romanucci M, Marinelli A, Sarli G, Della Salda L (2006) Heat shock protein expression in canine malignant mammary tumours. BMC Cancer 6:171
- Jin, C., Frayssinet, P., Pelker, R., Cwirka, D., Hu, B., Vignery, A., S.C., Eisenbarth, Flavell, R.A., NLRP3 inflammasome plays a critical role in the pathogenesis of hydroxyapatite-associated arthropathy, PNAS 2011 108 (36) 14867-14872
- Frayssinet, P., Rouquet, N., Mathon, D.,Bone cell transfection in tissue culture using hydroxyapatite microparticles. J Biomed Mater Res A. 2006 Nov;79(2):225-8.
- Frayssinet, P., Rouquet, N., Transfection of bone cells in vivo using HA-ceramics particles. Histological study. R., Pignatello (ed). Biomaterials. Applications for nanomedicine. Intech, Rijeka, Croatia, pp 229-238
- Ciocca, D.R., Calderwood, S.K., Heat shock proteins in cancer: diagnostic, prognostic, predictive, and treatment implications. Cell Stress & Chaperones (2005) 10 (2), 86–103
- Marconato, L., Frayssinet, P., Rouquet, N., Comazzi, S., Leone, V.F., Laganga, P., Rossi, F., Pezzoli, L., Aresu, L., Randomized, placebo-controlled, double-blinded chemo-immunotherapy clinical trial in a Pet Dog model of Diffuse Large B-cell Lymphoma: a successful combination. Published OnlineFirst December 3, 2013; doi: 10.1158/1078-0432.CCR-13-2283
- Ciocca DR, Frayssinet P, Cuello-Carrion FD. A pilot study with a therapeutic vaccine based on hydroxyapatite ceramic particles and self-antigens in cancer patients. Cell Stress Chaperones. 2007 Spring;12(1):33-43