Adrénaline auto-injectable
Un auto-injecteur d'adrénaline (ou d'épinéphrine) est un dispositif médical permettant d'injecter une dose mesurée ou des doses d'épinéphrine (adrénaline) au moyen de la technologie des auto-injecteurs. Il est le plus souvent utilisé pour le traitement de réactions allergiques aigües afin d'éviter un choc anaphylactique[1]. Le premier auto-injecteur d'épinéphrine a été mis sur le marché dans les années 1980. Les noms commerciaux les plus connus de ces injecteurs sont EpiPen, Anapen et Twinject.

Utilisations médicales
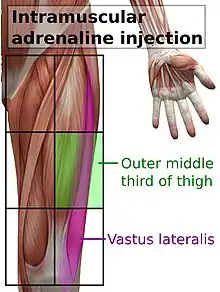
.jpg.webp)
Les auto-injecteurs d'adrénaline sont des dispositifs portatifs portés par les personnes souffrant d'allergies graves. L'adrénaline délivrée par le dispositif est un traitement d'urgence de la réaction anaphylactique[2] - [3].
En cas de suspicion d'anaphylaxie, une solution d'épinéphrine doit être administrée dès que possible par injection intramusculaire, au milieu du côté externe de la cuisse, ce qui correspond à l'emplacement du muscle vaste externe[4]. L'injection peut être répétée toutes les 5 à 15 minutes si la réponse est insuffisante[5]. Une deuxième dose est nécessaire dans 16 à 35 % des épisodes, avec plus de deux doses rarement nécessaires. Dans environ 80 % des cas où une deuxième dose est administrée, c'est par un professionnel de la santé[5]. Au début, il n'est pas clair de savoir quelles personnes pourraient avoir besoin d'une deuxième injection[5]. La voie intramusculaire est préférable à l'administration sous-cutanée, car celle-ci peut avoir une absorption retardée[5] - [6]. Les effets indésirables mineurs de l'adrénaline comprennent les tremblements, l'anxiété, les maux de tête et les palpitations[5].
L'épinéphrine dans les auto-injecteurs expire au bout d'un an[3]. Une étude chez le lapin a montré que l'épinéphrine intramusculaire avait une efficacité réduite après expiration. Cette étude a également recommandé que si le médicament contenu dans un appareil périmé n'a pas commencé à précipiter (si la solution n'est pas trouble et ne contient pas de particules), utiliser le dispositif périmé est préférable à l'absence d'injection en cas d'urgence[7].
Conception
Les dispositifs contiennent une dose fixe d'épinéphrine et une aiguille à ressort qui sort de la pointe ou du bord du dispositif et pénètre dans la peau du destinataire pour administrer le médicament par injection intramusculaire[3].
Les personnes à qui des auto-injecteurs d'épinéphrine sont prescrits doivent être formées à l'utilisation du dispositif spécifique prescrit[2] - [5]. Le taux d'injections non intentionnelles utilisant ces dispositifs est inconnu, mais une revue de 2009 a montré que ce taux était en augmentation[8]. Les injections involontaires sont administrées à un doigt ou à un pouce environ 90 % du temps; ils provoquent une douleur intense localement mais généralement complètement résolus[8]. La cause des injections involontaires a été attribuée à des défauts de conception, dans lesquels le dispositif est confondu avec un stylo ou l'utilisateur se trompe en indiquant l'extrémité de l'appareil contenant l'aiguille[8].
L’Agence européenne des médicaments a examiné la sécurité des dispositifs sur le marché et a mis en évidence plusieurs facteurs permettant de déterminer si les dispositifs délivrent le médicament dans le muscle, notamment la longueur de l’aiguille, l’épaisseur de la graisse sous la peau, la manière dont fonctionne (par exemple, si elle est à ressort ou non), l’angle auquel le dispositif est placé sur la peau et la force utilisée pour activer le dispositif ainsi que la mesure dans laquelle l’utilisateur respecte les instructions d’injection[9]. Il a constaté que la qualité de la formation des utilisateurs était le facteur le plus déterminant pour une utilisation réussie et a demandé aux entreprises de mettre au point de meilleurs supports de formation pour les médecins et les personnes à qui les dispositifs sont prescrits[9].
Une autre conception d'auto-injecteurs d'épinéphrine a été créée par deux frères qui utilisaient également des auto-injecteurs d'épinéphrine. Ils se sont rendu compte des inconvénients liés au port d’auto-injecteurs volumineux et ont décidé de proposer un nouvel appareil pour résoudre ces problèmes pendant leurs études. Les frères se sont séparés pour étudier différents domaines dans le but de créer un nouvel appareil. L'un des frères a fait un baccalauréat en génie et l'autre a obtenu un doctorat en sciences pharmaceutiques. Finalement, ils ont créé un design qui a la forme et la taille d’un smartphone et qui peut être rangé dans une poche. Le nouvel appareil comprend également une aiguille rétractable et des instructions vocales automatisées pour aider les utilisateurs à utiliser correctement les auto-injecteurs. Le produit a été lancé avec la marque "Auvi-Q"[10].
L'histoire
Les auto-injecteurs ont été développés à l’origine pour l’administration rapide d’antidotes aux gaz neurotoxiques dans des kits tels que le Mark I NAAK . Le premier auto-injecteur d'épinéphrine moderne, l'EpiPen, a été inventé au milieu des années 1970 par Sheldon Kaplan[11] - [12] chez Survie Technology à Bethesda, Maryland[13].
En 1996, Survival Technology a fusionné avec une société appelée Brunswick Biomedical, pour s'appeler Meridian Medical Technologies Inc.[14]. En 1997, Dey, une filiale de Merck KGaA, a acquis le droit exclusif de commercialiser et de distribuer EpiPen[15] - [16]. En 1998, un million d'EpiPens a été rappelé, le deuxième rappel de ce type en un an[17].
En 2001, Meridian et Dey ont présenté une version à deux composants de l’EpiPen. A cette époque, les ventes annuelles de l'appareil s'élevaient à 23,9 millions de dollars et représentaient 75 % du marché aux États-Unis[18]. En 2002, King Pharmaceuticals a acquis Meridian pour 247,8 millions de dollars en espèces[16]; l’accord a été finalisé en [19]. Kaplan a continué à améliorer ses dessins au fil des ans, en déposant par exemple le brevet US 6 767 336 en 2003[20].
En 2003, Hollister-Stier a reçu de la FDA l’autorisation de commercialiser un auto-injecteur d’épinéphrine appelé Twinject, capable de produire deux injections d’épinéphrine, qu’elle avait développée pendant dix ans[21] - [22] - [23]. En 2005, le produit a été vendu à Verus Pharmaceuticals[21] qui a lancé le produit la même année[24]. En , Sciele Pharma a acquis Twinject de Verus[25] et plus tard cette année-là, Sciele a été acquise par Shionogi[26].
En 2007, Mylan a acquis le droit de commercialiser EpiPen de Merck KGaA dans le cadre d’une transaction plus importante[27]. A cette époque, les ventes annuelles s'élevaient à environ 200 millions de dollars[28] et EpiPen détenait environ 90 % du marché[29].
En 2009, Mylan et King ont commencé à commercialiser une nouvelle version d’EpiPen avec le même mécanisme de base, mais avec un ressort plus puissant, des fonctions de sécurité améliorées et des marquages et instructions plus claires. Un expert de NBC News a estimé que le coût de la refonte de l’appareil et de l’emballage pouvait s’élever à «plusieurs millions de dollars» et que le coût du réoutillage du processus de fabrication pouvait «atteindre des millions à deux chiffres»[30].
Développement du marché
En 2009, Teva Pharmaceuticals a déposé une ANDA pour la commercialisation d'un générique EpiPen en collaboration avec Antares Pharma Inc, fabricant de systèmes d'injection. Pfizer et King les ont poursuivis en justice pour infraction au brevet américain 7 449 012 qui devait expirer en 2025[31]. Pfizer, Mylan et Teva ont conclu un accord en qui a permis à Teva de commencer à vendre le dispositif à la mi-2015, sous réserve de l'approbation de la FDA[32].
En 2009, Intelliject, une start-up américaine qui développait un nouvel auto-injecteur d'épinéphrine, a cédé son produit sous licence à Sanofi[33].
King a été acquis par Pfizer en 2010 pour 3,6 milliards de dollars en espèces[34].
En 2010, Sciele/Shionogi a rappelé les appareils Twinject[35] et a lancé Adrenaclick, une version modifiée de Twinject pouvant administrer une seule dose[36] - [37].
En 2010, les régulateurs européens ont approuvé Twinject[38] et aussi un nouvel auto-injecteur d'épinéphrine fabriqué par ALK et vendu sous la marque Jext[39] - [40]. Jext a été lancé dans l'Union européenne en [41] - [42].
Également en 2010, Shionogi a autorisé Greenstone, la division des génériques agréés de Pfizer[43] - [44] à commencer à vendre un générique autorisé d'Adrenaclick[45] - [46]. Les médias ont indiqué que Pfizer, par l'intermédiaire de Greenstone, commercialisait un auto-injecteur générique d'épinéphrine lorsque ce dernier avait acquis King plus tard dans l'année[47]. À cette époque, EpiPen de King et Mylan détenait 91 % des parts de marché mondiales des auto-injecteurs d'épinéphrine et 96 % du marché américain[47].
En 2010, Pfizer et King ont assigné l'unité générique Sandoz de Novartis en contrefaçon de brevet après que Sandoz eut soumis une ANDA pour vendre un EpiPen générique[48]. En réponse, Sandoz a contesté la validité des brevets et, en , ce litige était en cours[49].
En 2011, Pfizer et King ont poursuivi Intelliject et Sanofi après que les sociétés aient déposé une demande de drogue nouvelle 505 (b)(2)[50] pour le produit, alors dénommée "e-cue"[51]. Pfizer, Mylan et Sanofi ont conclu en 2012 un accord autorisant l'entrée de l'appareil sur le marché au plus tôt en , sous réserve de l'approbation de la FDA[52]. En , la FDA a approuvé l'auto-injecteur, appelé "Auvi-Q" après que la FDA ait demandé un changement de nom en "e-cue"[53]. L'appareil est équipé d'une puce audio qui fournit des instructions vocales électroniques pour guider l'utilisateur dans l'utilisation correcte de l'appareil[54] - [55].
En 2012, Mylan a lancé un programme appelé EpiPen4Schools pour vendre EpiPens en vrac et avec réductions à des écoles. Pour participer au programme, les écoles devaient accepter de ne pas acheter d'auto-injecteurs d'épinéphrine auprès d'une autre société pendant un an[56].
En , le National Association of State Boards of Education (en) a lancé une initiative visant à "aider les conseils d’enseignement publics à élaborer des politiques de santé des élèves concernant l’anaphylaxie et l’utilisation et l’auto-injection d’épinéphrine", responsabilité légale pour le stockage et l'utilisation d'auto-injecteurs d'épinéphrine. Gayle Conelly Manchin, mère de la directrice générale de Mylan, Heather Bresch, était devenue présidente de l'association en 2010 et avait discuté peu après des dons de la "société de sa fille" à l'association. Manchin avait été nommée au conseil scolaire de l'État de Virginie-Occidentale par son mari, Joe Manchin , alors gouverneur de l'État, en 2012[57].
En 2012, Shionogi, le fabricant d’Adrenaclick et de Twinject, a annoncé qu’il cesserait de les fabriquer[33] et qu'elle avait vendu les droits de la NDA à une société appelée Amedra Pharmaceuticals[58] - [59].
En , Amedra a relancé Adrenaclick [60]. Au même moment, Lineage Therapeutics lançait sa version générique autorisée d'Adrenaclick[61]. Lineage était une filiale à 100 % d'Amedra qui avait acquis les droits sur le générique autorisé Adrenaclick auprès de Greenstone/Pfizer[62].
Après un lobbying réussi de la part de Mylan[28] en 2013, la "Loi sur l’accès scolaire à l’épinéphrine d’urgence" est devenue loi après son adoption par le Congrès avec un large soutien bipartite; il protégeait quiconque de toute responsabilité s'il administrait de l'épinéphrine à un enfant dans une école (auparavant, seuls les professionnels qualifiés ou la personne concernée étaient autorisés à administrer le médicament et étaient passibles de responsabilité), et il offrait des incitations financières aux écoles qui n'en avaient encore de commencer à stockez des auto-injecteurs d’épinéphrine[63]. Joe Manchin, le père du PDG de Mylan, était sénateur à cette époque[57].
En , Mylan a déposé une pétition citoyenne auprès de la FDA soulevant des préoccupations concernant l'application de l'ETA par TEVA pour la commercialisation d'un générique EpiPen et a déposé un supplément plus tard en mai. La FDA a rejeté la pétition en juin[64] - [65].
En , Impax Laboratories a acquis la société mère Amedra et Lineage et a placé Amedra et Adrenaclick dans sa division Impax Specialty Pharma. Parallèlement, elle a acquis Lineage, qu'elle a placé avec sa version générique d'Adrenaclick dans sa division Impax Generics[66] - [67].
En , l'auto-injecteur d'épinéphrine Emerade développé par la société suédoise Medeca a été approuvé en Suède et en Allemagne[68]; il avait été approuvé au Royaume-Uni en 2013[69]. Toujours en 2015, Valeant, qui avait cédé les droits de Medeca, a abandonné ses efforts pour faire approuver Emerade aux États-Unis[70].
En , les dispositifs Auvi-Q ont été rappelés volontairement par Sanofi en Amérique du Nord[71] - [72]. La raison invoquée par Sanofi était qu’il avait été découvert que la posologie des produits était potentiellement inexacte, ce qui pouvait induire des défauts de délivrance du médicament[73]. En , Sanofi a résilié sa licence de fabrication et de commercialisation de l'Auvi-Q, laissant Kaléo (Intelliject a été renommé) se demander comment réintroduire le dispositif[74] - [75].
L'EpiPen occupait 89 % du marché des auto-injecteurs d'épinéphrine en 2015[56]; au premier semestre de l'année, il détenait environ 85 % du capital et Auvi-Q, environ 10%[28].
En , l'ANDA de Teva pour un générique EpiPen, qui avait déjà subi plusieurs retards, a été rejeté par la FDA[76].
En 2015, Mylan a réalisé des ventes d'EpiPens d'environ 1,5 milliard de dollars et ces ventes ont représenté 40 % des bénéfices de Mylan[28]. Mylan avait maintenu une part de marché d’environ 90 % depuis l’acquisition du produit et avait continuellement augmenté le prix d’EpiPens à partir de 2009: en 2009, le prix de gros de deux EpiPens était d’environ 100 USD; en , le prix était d'environ 265 $; en , il était d'environ 461 $; et en , le prix a de nouveau augmenté pour atteindre environ 609 $ [27] un bond d'environ 500 % par rapport au prix de 2009[77]. Le coût du médicament et du dispositif pour Mylan en 2016 était d'environ 35 $[30]. À l'été 2016, alors que les parents s'apprêtaient à renvoyer leurs enfants à l'école et à se rendre en pharmacie pour se procurer de nouveaux EpiPens, les gens ont commencé à exprimer leur indignation au prix de l'EpiPen et Mylan a été largement et durement critiqué[78] - [79]. En , le procureur général de l'État de New York a ouvert une enquête sur le programme EpiPen4Schools de Mylan à New York afin de déterminer si les contrats du programme violaient la loi antitrust[80] et le procureur général de l'État de Virginie-Occidentale a ouvert une enquête visant à déterminer si Mylan avait donné à l'État la remise correcte dans le cadre du programme de remboursement des médicaments Medicaid et a assigné la société à comparaître lorsqu'elle a refusé de fournir les documents demandés par l'État[79]. En , Mylan a annoncé un règlement de 465 millions de dollars avec le ministère de la Justice des États-Unis au sujet des remises versées par Mylan aux États dans le cadre du programme Medicaid Drug Rebate[81].
Le , la FDA a envoyé une lettre d'avertissement au fabricant, Meridian Medical Technologies, Inc. L'agence a mis en garde Meridian Medical pour son incapacité à enquêter sur les problèmes liés aux dispositifs, à rappeler les lots incorrects et à effectuer un suivi des problèmes détectés. Selon la FDA, le fabricant d’appareils EpiPen n’a pas corrigé les dysfonctionnements connus de ses auto-injecteurs, alors même que des centaines de plaintes de clients avaient été enregistrées et que les défaillances étaient liées à des décès. Au cours d'une inspection, les employés de Meridian ont déclaré aux inspecteurs qu'ils n'étaient pas autorisés à démonter et à enquêter sur des échantillons de plaintes, car ils n'étaient autorisés à le faire que si seulement «cela était approuvé par la direction»[82] - [79].
Le , la FDA a approuvé le premier générique EpiPen de Teva Pharmaceuticals[83] - [84].
Dans le but de remédier à la pénurie d’EpiPens[85], le , la FDA a approuvé la prolongation de quatre mois de la date de péremption de certains produits[86].
Société et culture
Marques
À compter de 2015, les auto-injecteurs d'épinéphrine suivants étaient disponibles dans diverses régions d'Europe: Adrenalina WZF, Adrénaline (épinéphrine) à 1 à 1000 solution pour l'auto-injecteur de BP, Altellus, Anapen, Emerade, EpiPen, Fastjekt, FastPen et Fast[87]. En 2018, trois produits de marque étaient disponibles aux États-Unis: Adrenaclick, Auvi-Q et EpiPen[7]. En 2005, les auto-injecteurs d'épinéphrine n'étaient pas disponibles dans la plupart des pays en développement[7].
Europe
En , deux EpiPens coûtaient environ 100 USD en France et environ 200 USD en Allemagne[42].
En , deux auto-injecteurs Jext coûtaient aux utilisateurs environ 8,50 £ (10,9 USD) en Grande-Bretagne et le National Health Service payait environ 48 £ (61,54 USD) pour les mettre à disposition. Ce prix était inférieur d'environ 17 % à celui de 2013[42].
La fourniture d'auto-injecteurs d'adrénaline de 150 microgrammes aurait été «critique» au Royaume-Uni en . Les pharmaciens communautaires ont été invités à donner la priorité aux fournitures destinées aux enfants de 25 kg ou moins. Mylan a identifié des pénuries en raison de problèmes de fabrication en [88].
US
En , le PDG de Mylan a déclaré au Congrès que Pfizer/King avait facturé environ 34,50 USD à Mylan pour un EpiPen[30]. Les appareils fournissent environ 1 $ de médicament[28]. En , un cabinet de conseil en ingénierie de la Silicon Valley a procédé à une analyse de démontage de l'EpiPen et a estimé les coûts de fabrication et d'emballage à environ 10 USD pour un pack de deux[89].
L'EpiPen, fabriqué par King, une filiale de Pfizer, et commercialisé par Mylan, a dominé le marché[56]. En 2007, lorsque Mylan a acquis les droits de commercialisation du produit, les ventes annuelles de tous les auto-injecteurs d'épinéphrine étaient d'environ 200 millions de dollars et EpiPen représentait environ 90 % du marché. En 2015, la taille du marché était d'environ 1,5 milliard de dollars et Mylan détenait toujours environ 90 % du marché[29] - [56]. Mylan a augmenté le prix d'environ 100 USD pour un ensemble de deux EpiPens en 2007 à environ 600 USD en 2016[77]. Au Royaume-Uni, un EpiPen coûte 26,45 £ à partir de 2015[90]. Au Canada, ils coûtent environ 120 CAD chacun[91].
Mylan a acquis le droit de commercialiser la gamme de dispositifs auto-injecteurs d'épinéphrine EpiPen de Merck KGaA dans le cadre de son contrat de 2007[27].Heather Bresch, PDG de Mylan, a vu une occasion d'augmenter les ventes aux États-Unis par le marketing et la promotion, et la société a lancé une campagne de marketing pour accroître la sensibilisation aux dangers de l'anaphylaxie pour les personnes souffrant d'allergies graves qui ont fait que la marque EpiPen est associée avec les auto-injecteurs d'épinéphrine comme Kleenex est pour les mouchoirs en papier; la société a également fait pression avec succès la FDA d'élargir les indications pour inclure le risque d'anaphylaxie et en parallèle, a fait pression avec succès le Congrès pour générer une législation rendant l'EpiPen disponible dans les lieux publics, tout comme les défibrillateurs le sont déjà, et a engagé les mêmes personnes que Medtronic avait chargé de travailler sur la législation du défibrillateur[28].
Les efforts de Mylan pour maintenir sa domination du marché ont été facilités lorsque le produit concurrent de Sanofi a été rappelé en et plus encore lorsque le concurrent générique de Teva a été rejeté par la FDA en [92]. Au premier semestre de 2015, les ventes d'EpiPen représentaient 40 % des bénéfices de Mylan[28]. Ces bénéfices sont également dus en partie au relèvement continu du prix des EpiPens par Mylan à compter de 2009: en 2007, le prix de gros de deux EpiPens s'élevait à environ 100 $; le prix était à peu près le même en 2009; en , le prix était d'environ 265 $; en , il était d'environ 461 $; et en , le prix a de nouveau augmenté pour atteindre environ 609 $ [27] un bond d'environ 500 % par rapport au prix de 2009[77]. La dernière augmentation de prix a provoqué un tollé général à la fin de l’été, alors que les parents s’apprêtaient à renvoyer leurs enfants à l’école et à se rendre en pharmacie pour se procurer de nouveaux EpiPens[78] - [79]. Certains Américains ont réagi au prix élevé en achetant EpiPens en ligne dans des pharmacies situées hors des États-Unis[93] - [79], en renonçant aux nouveaux EpiPens et en gardant leur EpiPen expiré[93] ou renonçant totalement à un auto-injecteur et obligeant leurs enfants à porter des seringues préchargées[79] - [94].
En réponse aux critiques, Mylan a augmenté l'aide financière offerte à certains patients pour l'achat d'EpiPens[95], un geste qualifié de "démarche classique en matière de relations publiques" par le professeur Aaron Kesselheim de la Harvard Medical School[96]. Les cartes d’épargne d’une valeur allant jusqu’à 300 $ ne peuvent être utilisées que par un petit nombre de personnes qui en ont besoin et pas par les personnes dépendant de Medicaid. Ils ne font rien face au prix élevé que paient encore les assureurs, qui finissent par en faire supporter les coûts aux consommateurs[96]. En , Mylan a annoncé un règlement avec le ministère de la Justice des États-Unis au sujet des remises versées par Mylan aux États dans le cadre du programme Medicaid Drug Rebate[81]. Le Congrès et d'autres ont soulevé des questions sur la raison pour laquelle EpiPen avait été classé comme produit générique plutôt que comme produit exclusif dans le programme depuis 1997. Les médicaments génériques bénéficient de remises moins élevées (13 %) que les médicaments propriétaires (23 %) et les hausses de prix des médicaments génériques ne peuvent pas être répercutées sur les États. Une forme courante de fraude pharmaceutique consiste à classifier les médicaments propriétaires en médicaments génériques dans le cadre du programme[79]. En vertu de cet accord, Mylan a accepté de verser un paiement de 465 millions de dollars et de signer un accord d’intégrité d’entreprise lui imposant d’améliorer ses performances futures[81]. Le règlement a également résolu des cas portés par des États liés aux rabais[79].
En , le médicament générique autorisé d'Adrenaclick coûtait 142 USD dans les magasins de détail[94] - [97].
En , un groupe de hackers appelé "Four Thieves Vinegar" a publié une vidéo et des documents décrivant ce qu'ils appellent un EpiPencil, un auto-injecteur pouvant être construit à l'aide de pièces standard, pour un prix d'environ 30 USD[98]. À sa base se trouve un auto-injecteur d’insuline recyclé[99]. Cet appareil n'a fait l'objet d'aucune validation par les organismes de réglementation[98].
Références
- EpiPen sur le site de la Haute Autorité de Santé
- « Anaphylaxis » [archive du ], National Institute of Allergy and Infectious Diseases, (consulté le )
- Dinakar, « Anaphylaxis in children: current understanding and key issues in diagnosis and treatment. », Current allergy and asthma reports, vol. 12, no 6, , p. 641–9 (PMID 22815131, PMCID 3492692, DOI 10.1007/s11882-012-0284-1)
- « Epinephrine Injection », MedlinePlus Last revised 03/15/2017
- Muraro et The EAACI Food Allergy and Anaphylaxis Guidelines Group, « Anaphylaxis: guidelines from the European Academy of Allergy and Clinical Immunology. », Allergy, vol. 69, no 8, , p. 1026–45 (PMID 24909803, DOI 10.1111/all.12437)
- Simons et Simons, FE, « Epinephrine and its use in anaphylaxis: current issues », Current Opinion in Allergy and Clinical Immunology, vol. 10, no 4, , p. 354–61 (PMID 20543673, DOI 10.1097/ACI.0b013e32833bc670)
- Song, Worm et Lieberman, « Anaphylaxis treatment: current barriers to adrenaline auto-injector use. », Allergy, vol. 69, no 8, , p. 983–91 (PMID 24835773, DOI 10.1111/all.12387, lire en ligne)
- Simons, Lieberman, Read EJ et Edwards, « Hazards of unintentional injection of epinephrine from autoinjectors: a systematic review. », Annals of Allergy, Asthma & Immunology, vol. 102, no 4, , p. 282–7 (PMID 19441598, DOI 10.1016/s1081-1206(10)60332-8)
- « Better training tools recommended to support patients using adrenaline auto-injectors », sur ema.europa.eu,
- Katie Thomas, « Brothers Develop New Device to Halt Allergy Attacks », New York Times, (lire en ligne, consulté le )
- Smetana, « EpiPen inventor helped millions and died in obscurity » [archive du ], St. Petersburg Times, (consulté le )
- National Inventors Hall of Fame Kaplan Sheldon « https://web.archive.org/web/20160131003008/http://invent.org/inductees/kaplan-sheldon/ »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?),
- Historique d'approbation FDA pour NDA 019430 - Page EpiPen consultée le 30 août 2016
- Dépôt 10-K de Meridian Medical Technologies Pour l'exercice terminé le 31 juillet 1997
- Dey, Inc. Modification n ° 3 du formulaire S-1 Déclaration d'enregistrement en vertu de la loi intitulée Securities Act of 1933. Déposé le 30 avril 1999.
- King Pharmaceuticals, le 21 octobre 2002. Communiqué de presse: King Pharmaceuticals acquiert Meridian Medical Technologies
- Marilyn Chase, « EpiPen Recall PointsTo Broader Concerns », Wall Street Journal, (lire en ligne)
- Meridian Medical Technologies, Merck KGaA. 03 avril 2001 Communiqué de presse: Meridian annonce le lancement du nouvel EpiPen 2-Pak
- Formulaire 11K de King Pharmaceuticals déposé pour l’exercice terminé le 31 décembre 2003.
- Brevet US 6 767 336 , cité dans Steve Brachmann pour IPWatchdog 28 juin 2016 EpiPen donne des doses d'épinéphrine qui sauvent des vies depuis près de 50 ans
- Jennifer Sudick pour le Spokane Spokesman-Review. 20 juillet 2005 Une entreprise de Spokane vend ses droits sur un auto-injecteur
- <Paquet d'approbation FDA Twinject
- Historique d'approbation FDA NDA 020800 - Pages Twinject et Adrenaclick consultées le 25 août 2016
- « Verus Pharmaceuticals Announces U.S. Launch of Twinject for Anaphylaxis » [archive du ], veruspharm.com
- Sciele Pharma. 13 mars 2008. Communiqué de presse: Sciele Pharma acquiert l'auto-injecteur d'épinéphrine Twinject® de Verus Pharmaceuticals
- Z + Kazuhiro Shimamua pour le Wall Street Journal. 1er septembre 2008: Shionogi achète Sciele Pharma
- Tara Parker-Pope et Rachel Rabkin Peachman pour le New York Times. 22 août 2016 L' augmentation des prix d'EpiPen suscite l'inquiétude des personnes souffrant d'allergies
- Cynthia Koons et Robert Langreth pour Bloomberg Businessweek. 23 septembre 2015 Comment le marketing a transformé l'épiPen en une entreprise valant des milliards de dollars
- (en) 1Carolyn Y. Johnson et Catherine Ho, « How Mylan, the EpiPen company, maneuvered to create a virtual monopoly », chicagotribune.com,
- (en) Ben Popken, « Upgraded EpiPens torn apart. Tech firm: "It's the same core device" », NBC News, (lire en ligne)
- US Patent 7,449,012 , cité dans le rapport de la cour du 07 septembre 2009 de PatentDoc
- Phil Milford pour Bloomberg News Le 26 avril 2012 Mylan et Pfizer parviennent à un règlement en épinéphrine-stylo avec Teva
- Katie Thomas pour le New York Times. 1 février 2013 Les frères développent un nouveau dispositif pour enrayer les attaques d'allergie
- « Pfizer Completes Acquisition Of King Pharmaceuticals, Inc.; Pfizer and King begin joint operations on March 1, 2011 » [archive du ], Pfizer,
- Recalls.org December 2010 « https://web.archive.org/web/20160829013442/http://www.recalls.org/d2010-12.htm »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?),
- Personnel, Référence de prescription mensuelle. 07 janvier 2010 Lancement d'un auto-injecteur Adrenaclick pour le traitement de l'anaphylaxie
- FDA / Shionogi Adrenaclick étiquette originale 2009
- Shionogi. Communiqué de presse du 31 août 2010 : Shionogi annonce des résultats positifs pour la procédure décentralisée d’approbation européenne de Twinject (auto-injecteur d’épinéphrine)
- « ALK media release (07 October 2010) » (consulté le )
- « ALK media release (13 October 2010) » (consulté le )
- « ALK media release (06 September 2011) » (consulté le )
- (en) James Paton et Naomi Kresge, « Why the $600 EpiPen Costs $69 in Britain », Bloomberg LP, (lire en ligne)
- (en) « Greenstone LLC - A Successful Business Model », Pharmacy Times, (lire en ligne)
- Scott Hensley, « Pfizer to Make Generic Version of Its Zoloft », The Wall Street Journal, (lire en ligne)
- Tucker, « Generic Epinephrine Injector May Cause Confusion », American College of Allergy, Asthma & Immunology (consulté le )
- « EPINEPHRINE injection [Greenstone LLC] » [archive du ], FDA via DailyMed, : « Marketing Category: NDA Authorized Generic; Application Number Or Monograph: NDA020800; Marketing Start Date: 03/31/2010 »
- (en) Jim Edwards, « In $3.6B King Deal, Pfizer Gets a Small but Important EpiPen Monopoly », CBS MoneyWatch (en), (lire en ligne)
- Julie Zeveloff pour Law360. 16 juillet 2010. King Pharma poursuit Sandoz contre EpiPen générique
- Rapport trimestriel Pfizer (Formulaire 10-Q) pour la période trimestrielle terminée le 3 juillet 2016
- Remarque - Un "505 (b) (2)" est un type de demande de nouveau médicament qui permet au demandeur de s’appuyer en partie sur les données d’approbation du médicament de quelqu'un d’autre. indication. Les informations sur le médicament lui-même sont celles de quelqu'un d'autre, mais le demandeur doit générer les données montrant que le médicament fonctionne pour la nouvelle indication. Dans le cas d’Intelliject, il s’agit du médicament générique d’un nouvel appareil. Pour une explication, voir Kenneth V. Phelps pour le magazine Drug Discovery & Development. 9 août 2012 Sur la route 505 (b) (2)
- Sherri Oslick pour PatentDocs. Rapport de cour le 23 janvier 2011
- Mylan. 16 février 2012 Communiqué de presse: Mylan et Pfizer annoncent un accord de règlement relatif à un auto-injecteur d'épinéphrine
- John Reid Blackwell pour le Richmond Times-Dispatch. 14 août 2012 La FDA approuve le dispositif de sauvetage d'Intelliject pour les personnes allergiques
- « Auvi-Q Fact Sheet » (consulté le )
- Sanofi, le 13 août 2012 Communiqué de presse: Sanofi annonce l'approbation de la FDA pour Auvi-Q
- (en) Ike Swetlitz et Ed Silverman, « Mylan may have violated antitrust law in its EpiPen sales to schools », STAT, (lire en ligne)
- (en) Jayne O'Donnell, « Family matters: EpiPens had high-level help getting into schools », USA Today, (lire en ligne)
- Conseil national des programmes de médicaments sur ordonnance Mai 2013 QUIC FORMULAIRE 201313 Auto-injecteur Adrenaclick, NDC 59630-0803-02 et 59630-0804-02 Résolution . Indexé ici
- Résultats financiers Shionogi pour l' exercice 2011: Supplément Voir la note en marge de la page 6
- Amedra Pharmaceutical, le 14 juin 2013 Communiqué de presse: Amedra Pharmaceuticals commercialise l'auto-injecteur Adrenaclick
- Thérapeutique de la lignée. 14 juin 2013 Communiqué de presse: Auto-injecteur d'épinéphrine générique autorisé par Lineage Therapeutics
- « Clinical Alert », Magellan Medical, (lire en ligne)
- Matt Novak, « How Congress, the FDA, and Sarah Jessica Parker Helped EpiPen Become a $1 Billion Business », Gizmodo, (lire en ligne)
- (en) Michael Gibney, « Could EpiPen's plastic cap be Mylan's secret weapon? », FiercePharma, (lire en ligne)
- « FDA-2015-P-0181: Requests that the FDA take certain actions with respect to abbreviated new drug application (ANDA) 90-589, submitted by Teva Pharmaceuticals (Teva), for an epinephrine auto-injector. », US Government Dockets Repository (consulté le )
- « Impax 2014 Annual Report » [archive du ] (consulté le )
- Impax March 10, 2015 Press Release: Impax Completes Acquisition Of Tower Holdings, Inc. And Lineage Therapeutics Inc. « https://web.archive.org/web/20160827154040/http://investors.impaxlabs.com/Media-Center/Press-Releases/Press-Release-Details/2015/Impax-Completes-Acquisition-Of-Tower-Holdings-Inc-And-Lineage-Therapeutics-Inc/ »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?),
- « Epinephrine self-injectable - Medeca Pharma AB - AdisInsight », Adis Insight (consulté le )
- « Emerade, 500 micrograms, solution for injection in pre-filled pen - Summary of Product Characteristics (SPC) - (eMC) », UK Electronic Medicines Compendium (consulté le )
- « Valeant Form 10-K For the fiscal year ended December 31, 2015 », SEC Edgar
- Tammie Smith, « Auvi-Q auto injector being recalled », Richmond Times-Dispatch,
- Associated Press, « Allerject epinephrine auto-injectors recalled by drugmaker Sanofi », Canadian Broadcasting Company,
- « Updated: Sanofi US Issues Voluntary Nationwide Recall of All Auvi-Q® Due to Potential Inaccurate Dosage Delivery »
- Jonathan Spiers, « French pharma giant vacates deal with Shockoe Slip firm », Richmond BizSense, (lire en ligne)
- Dan Stanton, « Sanofi abandoning Auvi-Q after dosage problems led to total recall », in-Pharma Technologist, (lire en ligne)
- Staff, The Pharma Letter. 3 mars 2016 Teva subit un revers sur le générique EpiPen
- Bartolotta, « Cost Jumps Nearly 500-Percent For Life-Saving EpiPens », CBS Baltimore, (consulté le )
- Goldberg, « People With Food Allergies Say Life-Saving Drug Too Expensive », KPBS Public Media (consulté le )
- (en) Joseph Walker, Ron Winslow et Anne Steele, « Mylan to Launch Cheaper Generic EpiPen Alternative », The Wall Street Journal, (lire en ligne)
- (en) Erik Larson et Jared S. Hopkins, « Mylan’s EpiPen School Sales Trigger N.Y. Antitrust Probe », Bloomberg LP, (lire en ligne)
- (en) Katie Thomas, « Mylan to Settle EpiPen Overpricing Case for $465 Million », The New York Times, (lire en ligne)
- (en) « 2017 - Meridian Medical Technologies, Inc. a Pfizer Company 9/5/17 », www.fda.gov (consulté le )
- (en) /pages/Allison-Gatlin/398136323711059, « Teva Pharma Approved To Make Generic Version Of Mylan's EpiPen », Investor's Business Daily, (lire en ligne, consulté le ).
- « FDA approves first generic version of EpiPen », sur U.S. Food and Drug Administration (consulté le ).
- Novak, « EpiPen Expiration Dates Extended as Schools Face Shortage of Allergy Medicine », Gizmodo, Gizmodo Media Group (consulté le )
- « Extended Use Dates Provided by Pfizer », FDA.GOV, United States Food and Drug Administration
- EMA. Annexe I : liste des noms, forme (s) pharmaceutique (s), concentration (s) du médicament, voie (s) d'administration, titulaire de l'autorisation de mise sur le marché dans les États membres. Publié le 25 avril 2014; Mise à jour le 26 août 2015. Voir la page d'index pour la revue EMA des auto-injecteurs d'Adrénaline.
- « Small children prioritised under emergency protocol to tackle 'critical' EpiPen shortage », Pharmaceutical Journal, (lire en ligne, consulté le )
- (en) Seipel Tracy, « Silicon Valley engineers figure real cost to make lifesaving auto-injector two-pack », The Mercury News, (lire en ligne)
- British National Formulary (BNF) 69, 69, (ISBN 9780857111562), p. 215
- « Canadians users of EpiPen not subject to price hike as U.S. consumers », (consulté le )
- Carly Helfand pour FiercePharma 1 mars 2016 La FDA insiste sur la copie Epeven de Teva, mettant Mylan au contrôle de la croisière
- (en) Brad Tuttle, « 5 Signs That EpiPen Prices Are Completely Out of Control », Money, (lire en ligne)
- Ginger Skinner, « Can You Get A Cheaper EpiPen? », Consumer Reports,
- « Mylan to provide EpiPen cost assistance as CEO is asked to testify on price hike | Business | The Guardian »
- (en) Carolyn Y. Johnson, « Why Mylan’s ‘savings card’ won’t make EpiPen cheaper for all patients », The Washington Post, (lire en ligne)
- Epipen souffre du manque de concurrence, Adam Rubenfire, Modern Healthcare, 28 mars 2016
- Eliza Strickland, « Hackers Offer a DIY Alternative to the $600 EpiPen », IEEE Spectrum, (consulté le )
- « Introducing the EpiPencil », Four Thieves Vinegar, (consulté le ).
Lectures complémentaires
- Fromer, « Prevention of anaphylaxis: the role of the epinephrine auto-injector. », The American Journal of Medicine, vol. 129, , p. 1244–1250 (PMID 27555092, DOI 10.1016/j.amjmed.2016.07.018, lire en ligne) Fromer, « Prevention of anaphylaxis: the role of the epinephrine auto-injector. », The American Journal of Medicine, vol. 129, , p. 1244–1250 (PMID 27555092, DOI 10.1016/j.amjmed.2016.07.018, lire en ligne) Fromer, « Prevention of anaphylaxis: the role of the epinephrine auto-injector. », The American Journal of Medicine, vol. 129, , p. 1244–1250 (PMID 27555092, DOI 10.1016/j.amjmed.2016.07.018, lire en ligne) Fromer, « Prevention of anaphylaxis: the role of the epinephrine auto-injector. », The American Journal of Medicine, vol. 129, , p. 1244–1250 (PMID 27555092, DOI 10.1016/j.amjmed.2016.07.018, lire en ligne) (Document de synthèse financé par Mylan, fabricant du produit EpiPen)
- Frew, « What are the 'ideal' features of an adrenaline (epinephrine) auto-injector in the treatment of anaphylaxis? », Allergy, vol. 66, no 1, , p. 15–24 (PMID 20716315, DOI 10.1111/j.1398-9995.2010.02450.x, lire en ligne) Frew, « What are the 'ideal' features of an adrenaline (epinephrine) auto-injector in the treatment of anaphylaxis? », Allergy, vol. 66, no 1, , p. 15–24 (PMID 20716315, DOI 10.1111/j.1398-9995.2010.02450.x, lire en ligne) Frew, « What are the 'ideal' features of an adrenaline (epinephrine) auto-injector in the treatment of anaphylaxis? », Allergy, vol. 66, no 1, , p. 15–24 (PMID 20716315, DOI 10.1111/j.1398-9995.2010.02450.x, lire en ligne) Frew, « What are the 'ideal' features of an adrenaline (epinephrine) auto-injector in the treatment of anaphylaxis? », Allergy, vol. 66, no 1, , p. 15–24 (PMID 20716315, DOI 10.1111/j.1398-9995.2010.02450.x, lire en ligne) Frew, « What are the 'ideal' features of an adrenaline (epinephrine) auto-injector in the treatment of anaphylaxis? », Allergy, vol. 66, no 1, , p. 15–24 (PMID 20716315, DOI 10.1111/j.1398-9995.2010.02450.x, lire en ligne) (Document de synthèse financé par ALK, fabricant du produit Jext)