Théorie de l'atome cubique
La théorie de l'atome cubique fut un des premiers modèles atomiques dans lequel les électrons étaient positionnés aux huit sommets d'un cube pour un atome ou une molécule non polaire. Cette théorie fut développée en 1902 par Gilbert N. Lewis et publiée en 1916 dans le célèbre article The Atom and the Molecule puis utilisée pour la description du phénomène de valence. La base de cette théorie fut structurée à partir de la loi d'Abegg. Elle fut complétée en 1919 par Irving Langmuir sous l'appellation de modèle d'atome à octet cubique. La figure ci-dessous montre les structures des éléments de la seconde période de la classification selon ce modèle d'atome cubique.
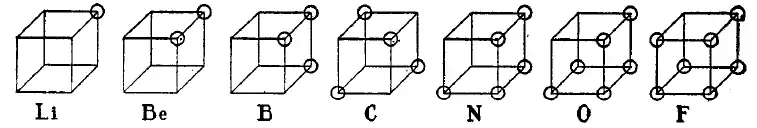
Bien que le modèle cubique d'atome fut rapidement abandonné en faveur du modèle quantique basé sur l'équation de Schrödinger, et ne soit plus désormais que d'intérêt historique, il représenta une étape importante dans la compréhension de la liaison chimique. L'article de 1916 de Lewis introduisait aussi le concept de paire électronique dans la liaison covalente, la règle de l'octet et ce qui est maintenant appelé structure de Lewis.
La liaison dans le modèle de l'atome cubique
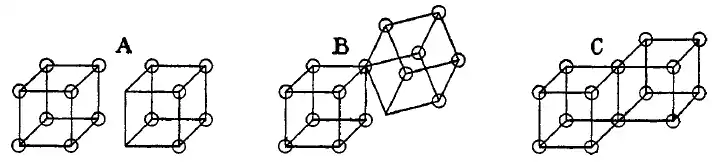
Les liaisons simples covalentes sont formées dans ce modèle par deux atomes partageant un côté, comme dans la structure C ci-dessous. Cela résulte dans le partage de deux électrons. Les liaisons ioniques sont formées par le transfert d'un électron d'un cube vers un autre, sans partage d'un sommet (A). Un état intermédiaire B avec un partage d'un seul électron était aussi postulé par Lewis.
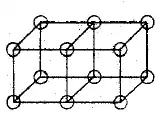
Les doubles liaisons sont formées par le partage d'une face entre deux atomes cubiques. Cela donne un partage de quatre électrons :
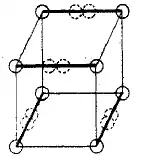
Les liaisons triples ne peuvent pas être prises en compte dans le modèle d'atome cubique, car il n'existe aucun moyen de partager 6 sommets entre deux cubes. G. Lewis suggéra que les paires d'électrons dans les liaisons atomiques montraient une attraction spécifique, qui pouvait résulter en une structure tétraédrique, comme indiqué dans la figure ci-dessous (la nouvelle localisation des électrons est représentée par les cercles pointillés au milieu des arêtes en gras). Cela permet la formation d'une liaison simple par partage d'un sommet, une liaison double par partage d'une arête, et la triple en partageant une face. Cette hypothèse prend aussi en compte les rotations libres autour des liaisons simples et pour la géométrie tétraédrique du méthane. On peut dire de manière surprenante qu'il existe un soupçon de vérité dans cette idée, car il fut montré plus tard que le principe d'exclusion de Pauli induit un « trou de Fermi » de répulsion décroissante entre une paire d'électrons de spins opposés dans la même orbitale.
Références
Voir aussi
Lien externe
- (en) L'article de Lewis
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Cubical atom » (voir la liste des auteurs).