Spectroscopie de fluorescence atomique à vapeur froide
La spectroscopie de fluorescence atomique par vapeur froide (CVAFS) est une technique efficace pour déterminer la concentration du mercure. C’est une des méthodes les plus sensibles pour analyser ce composé, en particulier dans l’environnement, puisque la contamination au mercure est une des plus grandes problématiques de notre atmosphère[1]. Cette méthode a été créée afin de rendre le mercure à son niveau d’oxydation le plus bas, à l’aide d’un agent réducteur, pour qu'à la suite de plusieurs étapes, le mercure sous la forme gazeuse, ait la possibilité de passer ou non par un amalgameur d’or. Finalement, les électrons sont excités et ramenés à leur état fondamental, là où ils émettent l’énergie absorbée[2] - [3] - [4]. Cette méthode vise à déterminer la concentration du mercure à l’état de trace, et ce de façon précise.
Histoire

La première mention du mercure dans l’histoire date du IVe siècle av. J.-C. C’est Aristote qui a décrit le mercure comme étant de l’«argent liquide». À cette époque, les risques liés à l’utilisation de cet élément étaient déjà connus[5].
Toutefois, cela n’a pas empêché les chapeliers, lors du XIXe siècle, de l’utiliser pour traiter les fourrures servant à la fabrication de chapeaux en feutres. En raison des effets nocifs sur le cerveau, les chapeliers avaient d’importants symptômes d’hydrargyrisme, inspirant le célèbre personnage de Lewis Carroll; le Chapelier Toqué[5] (Figure 1).
Ce n’est que bien plus tard que la détection et quantification du mercure a fait son apparition dans les méthodes analytiques. En 1964, Winefordner et Vickers ont inventé la spectroscopie de fluorescence, dans le but de déterminer la concentration d’éléments chimiques variés[6]. La technique de spectroscopie de fluorescence par vapeur froide a donc ainsi pu connaitre ses débuts.
Principe de la fluorescence
En spectroscopie de fluorescence, les électrons de certaines molécules ou des atomes gazeux (en émission de fluorescence atomique) sont excités en absorbant des rayons électromagnétiques, en UV et visible, selon leur longueur d’onde d’absorption[5]. Il en résulte ainsi un changement de niveau d’énergie à la hausse des électrons des atomes. En effet, chaque niveau électronique (S) possède plusieurs niveaux vibrationnels[7] (1, 2, 3, …), comme dans le diagramme partiel de Jablonski de la Figure 2 ci-dessous.
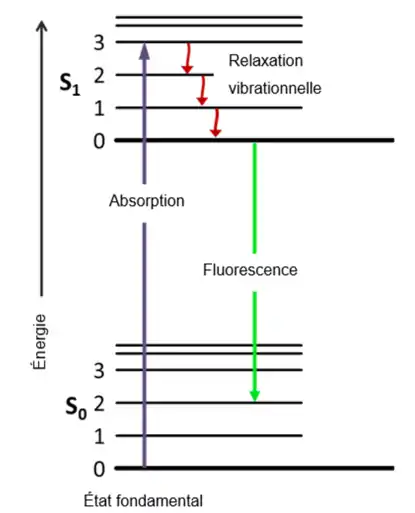
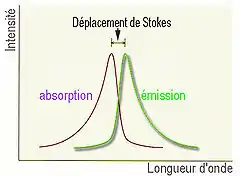
Le retour des électrons excités à un état inférieur ou fondamental s’appelle relaxation. En revenant à leur niveau fondamental, les électrons peuvent passer par des sous-niveaux d’énergie appelés niveaux d’énergie vibrationnels. Ce type de relaxation entre les niveaux d’énergie peut se produire lorsque les électrons excités transfèrent leur surplus d’énergie à des molécules de solvant[5]. Une fois revenus à leur niveau énergétique fondamental, les électrons émettent de la chaleur ou des photons, soit une relaxation non rayonnante ou rayonnant, aussi appelée émission de fluorescence. Dans le cas de la fluorescence, des photons sont émis par les électrons à une certaine longueur d’onde pendant quelques secondes (habituellement d’une durée allant de 10-10 à 10-5 secondes)[5]. Ainsi, les photons peuvent être détectés et permettent de différencier les molécules et les atomes selon la longueur d’onde émise observée. Par contre, il est important de noter que la longueur d’onde d’émission et la longueur d’onde d’absorption sont différentes dû au temps requis aux électrons pour passer du niveau excité au niveau fondamental; c’est le déplacement de Stokes (Figure 3)[5].
Cependant, seulement certaines molécules peuvent émettre de la fluorescence. Effectivement, la plupart du temps, un processus de relaxation non radiatif est plus rapide qu’un processus radiatif[8]. Donc, c’est la nature des molécules ainsi que la longueur d’onde d’excitation qui indiquent si elles émettent ou non de la fluorescence. Par exemple, une molécule ayant une longueur d’onde d’excitation plus faible que 250 nm ne pourrait pas fluorescer, puisque les rayonnements sous 250 nm sont plus énergétiques et pourraient briser des liens de la molécule[7]. Aussi, les molécules qui fluorescent le plus sont plus rigides, possèdent un ou plusieurs noyaux aromatiques ainsi que des groupements électrodonneurs[7].
Un avantage de la fluorescence par rapport à l’absorbance dans la détection de composés est la sensibilité des méthodes. En effet, les méthodes de détection par émission de fluorescence sont jusqu’à 1000 fois plus sensibles que les méthodes d’absorption. Effectivement, en fluorescence, la puissance rayonnante émise est proportionnelle à l’intensité de la source lumineuse, tandis qu’en absorbance la puissance rayonnante est indépendante de l’intensité de la source[5]. D'autres avantages en fluorescence sont les facteurs augmentant la fluorescence. Ceux-ci sont les impuretés et les complexations. En effet, des impuretés ou des agents complexant, peuvent augmenter la fluorescence émise en augmentant la rigidité des molécules.
Un inconvénient de la fluorescence est la diminution de la puissance rayonnante émise ou « quenching ». Des agents quenchants peuvent diminuer la fluorescence en brisant des liens d’une molécule, et donc en diminuant sa rigidité et par le fait même, sa fluorescence. Aussi, l’augmentation de la température peut avoir un effet quenchant sur l’émission de fluorescence. Effectivement, plus la température augmente, plus il y a de collisions efficaces entre les molécules de solvant et de soluté, diminuant ainsi la fluorescence[7].
Fonctionnement de la technique
La méthode de vapeur froide pour analyser le mercure est une technique qui est considérée simple. Au départ, il y a présence de mercure ionique dans la solution acide. Celui-ci sera par la suite réduit par un ion stanneux dans l’idée d’avoir dorénavant le mercure à l’état fondamental. Malgré la simplicité de la technique, il y a plusieurs facteurs qui peuvent affecter une analyse[9].
Principe théorique
Pour cette technique, l’échantillon que l’on veut analyser doit être sous forme de solution aqueuse. Si ce n'est pas le cas, une digestion doit être faite pour le solubiliser. Comme c’est une méthode spécifique pour le mercure, l’analyte dont il sera question pour expliquer le fonctionnement de la méthode sera le mercure.
Donc, une fois le mercure en solution, il est inséré dans un système où il sera réduit par une digestion acide. Pour ce faire, il est aspiré dans un tube à l’aide d’une pompe péristaltique. Dans un deuxième tube, un agent réducteur, tel que du chlorure stanneux, est aspiré. Les deux tubes se rejoignent dans une boucle de mélange, ou encore dans une chambre de réaction, où la réaction entre les deux réactifs se produit. L’agent réducteur réduit le mercure à son niveau d’oxydation le plus bas, soit en Hg0 :
Si le mercure fait partie d’une molécule plus complexe, la réaction de réduction permet de le libérer de celle-ci[3].
Un gaz vecteur est inséré dans le système afin de faciliter le mélange entre le Hg et l’agent réducteur. Il permet aussi d’entraîner le mélange dans une chambre de séparation gaz/liquide[3]. On utilise un gaz vecteur inerte pour transporter le mélange dans cette chambre de séparation, où le gaz utilisé est barboté dans le mélange. À la suite de la réaction de réduction, le mercure se retrouve sous forme gazeuse, donc le gaz entraîne le mercure avec lui lorsqu'il est barboté dans le mélange. Il est important d’utiliser un gaz noble pour cette méthode puisque ceux-ci sont inertes, afin de s’assurer que le signal absorbé et émis dans le détecteur de fluorescence provient uniquement de l’analyte et non du gaz.
Une fois que le mercure est entraîné sous forme gazeuse, il est transporté par le gaz à travers un séchoir. Celui-ci permet de s’assurer que le mélange gazeux ne soit pas saturé en vapeur d’eau ou encore qu’il ne condense pas plus loin dans le système. Comme cette technique est très sensible, le séchage du mélange gazeux est important, car il permet de réduire les possibilités d’interférences. Pour sécher, on introduit un second courant du même gaz vecteur dans le séchoir. Il est aussi possible de le chauffer légèrement[5] - [4].
Par la suite, l’échantillon arrive à une valve où il peut, ou non, passer dans un amalgameur d’or. S’il passe par le chemin où se trouve l’amalgameur d’or, il est piégé sur celui-ci. L’amalgameur agit comme une trappe afin de concentrer l’échantillon avant son entrée dans le détecteur de fluorescence. Une fois qu’il y a assez de mercure accumulé, une légère impulsion de chaleur est donnée pour libérer le mercure. Ainsi, il est possible d’avoir un signal plus fort pour les échantillons où la concentration en mercure serait à l’état de trace. Si la concentration de l’échantillon est assez grande pour être au-dessus de la limite de détection, il faut simplement placer la valve dans la position qui permet au mercure de contourner l’amalgameur d’or[2] - [3] - [4].
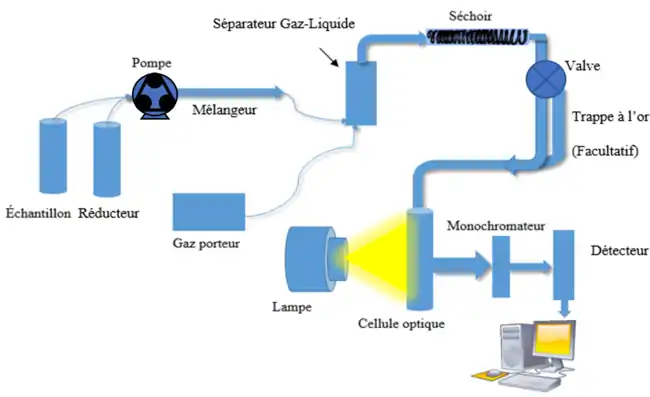
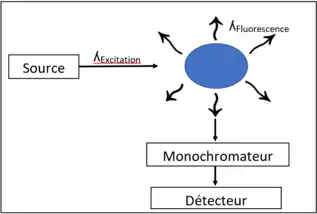
Une fois l’échantillon réduit, vaporisé et concentré, il entre finalement dans la cellule de fluorescence. Un rayon incident de longueur d’onde d’excitation de 253,7 nm est absorbé par le mercure. Les électrons de la couche de valence sont donc excités et montent à un niveau énergétique supérieur. Ils redescendent ensuite à leur état fondamental, émettant ainsi l’énergie absorbée. En revenant à leur état fondamental, l’énergie émise est lue à un angle de 90° par rapport au rayon incident pour éviter de fausser la mesure en lisant l’énergie émis par la source (Figure 5)[2] - [3] - [4].
La fluorescence est émise de façon égale dans toutes les directions et son intensité est proportionnelle à la concentration en mercure. Le détecteur reçoit un signal continu, car des vapeurs de mercure sont générées aussi longtemps qu’il y a des réactifs[3].
Performance de l'appareil
La spectroscopie de fluorescence atomique à vapeur froide (CVAFS) est une méthode qui permet des analyses très sensible. On constate que cette méthode offre une gamme dynamique qui est plus large que ce que permet la spectroscopie d’absorption atomique à vapeur froide. De plus, l’avantage de la méthode par fluorescence est que la limite de détection se trouve inférieure à des ppt. Il existe deux types de configuration pour l’instrument CVAFS. Pour la première configuration, il s’agit d’utiliser la détection de fluorescence atomique. Cette technique permet une limite de détection aux alentours de 0,2 ppt. En ce qui concerne le deuxième type de configuration, un système d’amalgamation d’or est utilisé. Celui-ci a pour objectif de pré-concentrer le mercure avant qu’il arrive à la détection de fluorescence atomique. Pour cette méthode, la limite de détection s’oriente davantage vers 0,02 ppt[4].
Avantages et Inconvénients
Le mercure est un élément qui est créé naturellement et il est en trace dans l’environnement. Il provient de la croûte terrestre, par sources anthropiques, c’est-à-dire, les activités humaines. Par exemple, le dégazage naturel est une des contaminations les plus importantes pour le mercure, soit avec des émissions allant jusqu’à 6000 tonnes par an[10]. Ainsi, dû au fait que le mercure est un élément toxique qui provoque beaucoup de contaminations à l’état de trace, il est important, malgré tout, d’avoir accès à des instruments sensibles.
La spectroscopie d'absorption atomique fait davantage face à des interférences dues à l’effet de trempe lors de l’analyse, ce que la fluorescence n’est pas influencé[11]. Ainsi, dû au fait que des traces sont analysées de l’ordre des ppt, l’analyse ne doit pas être affectée par des interférences. La spectroscopie par fluorescente est à la base, une des méthodes les plus sensibles pour analyser le mercure dans l’environnement, soit dans les eaux, les sols et dans l’air. Donc, la spectroscopie par fluorescence atomique à vapeur froide est une technique qui a été créée pour améliorer la sensibilité de la méthode, sa limite de détection, ainsi que son automatisation[12]. La méthode de spectroscopie par fluorescence est alors plus sélective et sensible que pour la méthode d’absorption atomique. De plus, la méthode CVAFS permet d’être linéaire sur une gamme de concentration qui est jusqu'à 105 fois plus large[13].
Cette méthode a des inconvénients quant au fait, que toutes les espèces moléculaires sont présentes dans le gaz porteurs. Par exemple, ceux qui sont en grande quantité sont l’O2 et le N2. L’inconvénient de leur présence dans le gaz porteur, est que ceux-ci diminuent le signal de fluorescence. Par ce fait, les résultats sont affectés. Une des techniques qui a été créée pour contrer cet effet négatif, est d’utiliser des pièges d’or, ayant l’objectif de récolter le mercure qui provient du flux de gaz de combustion. En chauffant par la suite, le mercure est extrait de l’or et celui-ci est transporté au détecteur à l’aide d’un gaz porteur inerte. Ainsi, le signal de la fluorescence n’est plus affecté par les espèces moléculaires du gaz porteur et permet une analyse plus sensible et avec une limite de détection de < 0,1 pgm-3[13].
Applications
Problématique du mercure dans l'environnement
Le mercure est problématique dans l’environnement puisqu’il est toxique. Il est donc important de pouvoir le doser de façon fiable. En effet, il se retrouve dans l’environnement dû à des sources anthropiques ainsi qu’en infime quantité par les microorganismes qui en produisent. Ainsi, puisque les sources industrielles émettent du mercure, celui-ci peut s’évaporer facilement et être transporté par les vents. Donc, la contamination peut être très large, comme elle peut être localisée. Aussi, comme il est possible de le voir dans le cycle biogéochimique du mercure dans l’environnement, le mercure subit plusieurs transformations dans l’environnement, soit sous forme organique (sous sa forme méthylé) ou inorganique[1].
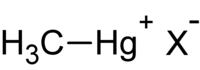
C’est le méthylmercure qui est la forme la plus toxique et la plus bioaccumulable, c’est-à-dire qui s’accumule dans les organismes de la chaîne alimentaire[1]. Ainsi, même s’il n’est présent qu’en petite quantité dans l’eau, sa concentration augmente avec les niveaux de la chaîne alimentaire. De plus, lorsqu’il est ingéré via du poisson, par exemple, le méthylmercure est absorbé en majorité dans l’estomac, passe par le tractus intestinal, puis par le système sanguin qui le distribue dans tout l’organisme[1]. Le mercure sous sa forme méthylé peut passer la barrière hémato-encéphalique pour accéder au cerveau et chez les femmes enceintes, il peut passer la barrière placentaire et atteindre le fœtus[1]. Ainsi, chez les enfants à naître, le méthylmercure peut causer des dégâts neurologiques, des retards mentaux et peut interagir avec le développement des enfants[1].
Références
- Gouvernement du Canada, « Le mercure : Votre santé et l'environnement : Outil de ressources », sur Gouvernement du Canada,
- An Introduction to Fluorescence Spectroscopy, Buckinghamshire, United Kingdom, PerkinElmer,
- Douglas A. Skoog, Fundamentals of analytical chemistry., Belmont, CA, Thomson-Brooks/Cole, , 8e éd. (ISBN 0-03-035523-0, OCLC 52942967, lire en ligne)
- Kriszta Venczel et Béla G. Lipták, Instrument and automation engineers' handbook. Volume II, analysis and analyzers, Boca Raton, United States, CRC Press, , Fifth edition éd. (ISBN 978-1-4987-2768-6, OCLC 960706941, lire en ligne)
- Douglas A. Skoog (West, Donald M., Holler, F. James., Crouch, Stanley Ross, (1940- ...)., Buess-Herman, Claudine., Dauchot-Weymeers, Josette.), Chimie analytique, Bruxelles, Groupe De Boeck, , 2e éd. (ISBN 978-2-8041-6295-5 et 2-8041-6295-8, OCLC 800555918, lire en ligne)
- J. D. Winefordner et T. J. Vickers, « Atomic Fluorescence Spectroscopy as a Means of Chemical Analysis. », Analytical Chemistry, vol. 36, no 1, , p. 161–165 (ISSN 0003-2700, DOI 10.1021/ac60207a052, lire en ligne)
- Gwenola Burgot et Jean-Louis Burgot, Méthodes instrumentales d'analyse chimique et applications : méthodes chromatographiques, électrophorèses et méthodes spectrales, Paris, Éditions Tec & Doc, , 2e éd., 320 p. (ISBN 2-7430-0878-4, OCLC 71828266, lire en ligne)
- Francis Rouessac, Daniel Cruché et Annick Rouessac, Analyse chimique : méthodes et techniques instrumentales modernes : cours et exercices corrigés, Paris, Dunod, , 6e éd. (ISBN 978-2-10-048425-6, OCLC 56928723, lire en ligne)
- Douglas E. Shrader et William B. Hobbins, « The Determination of Mercury by Cold Vapor Atomic Absorption », sur Agilent Technologies,
- Patricia Cava-Montesinos, Eva Ródenas-Torralba, Ángel Morales-Rubio, M. Luisa Cervera et Miguel De la Guardia, « Cold vapour atomic fluorescence determination of mercury in milk by slurry sampling using multicommutation. », Spain, Department of Analytical Chemistry, Faculty of Chemistry, University of Valencia, Research Building,
- « Atomic absorption spectrometry technology », Mercury Instruments USA
- Kozin L. F. et Steve C. Hansen, Mercury Handbook : Chemistry, Applications and Environmental Impact, Cambridge, RSC Publishing, , 219 p. (ISBN 978-1-84973-409-7, OCLC 868916960, lire en ligne)
- Evan J. Granite, Henry W. Pennline et Constance Senior, Mercury control : for coal-derived gas streams, Weinhem, Germany, Wiley-VCH, , 480 p. (ISBN 978-3-527-32949-6, OCLC 890796156, lire en ligne)
