Spectroscopie dans l'infrarouge proche
La spectroscopie dans l'infrarouge proche (ou dans le proche infrarouge, SPIR), souvent désignée par son sigle anglais NIRS (near-infrared spectroscopy), est une technique de mesure et d'analyse des spectres de réflexion dans la gamme de longueurs d'onde 0,78 à 2,5 µm (l'infrarouge proche[alpha 1]).
Cette technique est largement utilisée dans les domaines de la chimie (polymères, pétrochimie, industrie pharmaceutique), de l’alimentation, de l’agriculture[1] ainsi qu'en planétologie. À ces longueurs d’onde, les liaisons chimiques qui peuvent être analysées sont C-H, O-H et N-H[2]. Utilisée pour la première fois en 1964, cette technique a d'abord servi à mesurer très rapidement le pourcentage d’humidité des semences. Elle est rapidement devenue une technique de choix dans les domaines les plus variés[3].
Découverte et recherche sur le spectre infrarouge
Découverte du spectre infrarouge
La première mention dans l’histoire de la notion du spectre infrarouge remonte à la découverte faite par Sir William Herschel[4]. Astronome britannique, il étudia l’effet de chauffage causé par le spectre des radiations solaire. Il prouva ses recherches en causant la diffraction des rayons lumineux sur trois thermomètres. Comme prévu, vers les longueurs d’onde de la lumière rouge du spectre du visible, le changement de température devenait apparent, puis l’effet s’intensifiait juste au-dessus de cette longueur d’onde, soit 780 nm. Il conclut sa recherche en nommant sa découverte la <<lumière radiatrice>>. Se trouvant dans le <<spectre thermométrique>>, il considérait, à tort, cette énergie différente de celle de la lumière[3]. Il fallut attendre les recherches d’Ampere en 1835, qui expérimentait alors avec une invention récente, le thermocouple, pour déterminer que le spectre infrarouge avait les mêmes caractéristiques que la lumière visible. Ce fut la découverte du <<spectre étendu>>, regroupant les spectres connus de différentes longueurs d’onde en classes (visible, rayon X, infrarouges, etc.) et qui est encore utilisé à ce jour. Après cette découverte, les recherches furent ralenties, car jusqu’au milieu du siècle passé, les chercheurs ne voyaient pas d’intérêt analytique à celui-ci[2].
Première utilisation de la SPIR pour analyse
La première mention d’une analyse utilisant le spectre proche infrarouge comme longueur d’onde d’analyse a été menée par Abney et Festing sur différents liquides organiques à des longueurs d’onde de 1 à 1,2 µm en 1881[1]. Ils utilisaient alors comme instrumentation la plaque photographique, inventée en 1829, et dont il avait été noté que celle-ci avait une certaine sensibilité aux rayons infrarouge. Non seulement il s’agit de la première mesure, mais plus important, cela représente la première interprétation dans le proche infrarouge. En effet, ils réussirent à identifier les deux groupements présents dans les solutions et reconnurent aussi l’importance des interactions avec l’hydrogène dans le spectre infrarouge[1].
Le tout premier spectromètre en proche infrarouge
C’est en 1905 que W.W. Coblentz, inspiré par les découvertes d’Abney et Festing, décida de pousser les recherches en construisant le premier spectromètre proche infrarouge à avoir enregistré des mesures. Son appareil était composé d’un prisme à base de sel et de différents minéraux pour diffracter les rayons infrarouges et d’une thermopile reliée à un galvanomètre à miroirs (petit instrument qui enregistre les différences de courants et les transforme en signal). Son appareil était si sensible aux conditions extérieures qu’après chaque analyse, Cobentz devait transférer son appareil dans une salle blanche pour lui permettre de se recalibrer[2]. Son analyse lui permit néanmoins de faire plusieurs découvertes très importantes pour la SPIR, soit la lecture du spectre infrarouge de plusieurs centaines de composés organiques dans les régions de 1 à 15 µm. Il put ainsi déterminer, entre autres, qu’aucune molécule, même ayant la même formule moléculaire brute (par exemple les isomères), n’avait le même spectre IR, et qu’il serait donc possible de les qualifier par cette méthode. Il réussit aussi à analyser certaines régularités dans le spectre proche infrarouge, par exemple la bande de la fonction –OH se trouvant toujours à 2,7 µm et il spécula sur un type d’interactions qu’il appela les harmoniques[1].
Les recherches modernes
La toute première utilisation d’un appareil moderne fonctionnant dans le spectre infrarouge est attribuée à l’équipe de recherche dirigée par Norris en 1964, qui s’en servit pour calculer la quantité d’humidité dans les semences[2] - [3]. En réponse à cette première expérience concluante, il ne fallut pas longtemps pour que la recherche soit relancée. Les innovations dans le domaine de l’électronique et des composants optiques permirent de fabriquer des ordinateurs capables de traiter plus facilement et rapidement les données issues de ces spectres. Le fait de pouvoir utiliser la technique autant sur les produits solides que liquides avec, dans la grande majorité des cas, aucun prétraitement causa l’expansion de son utilisation dans tous les domaines et les recherches sur celle-ci devinrent une priorité. Utilisée dans un premier temps surtout sur les récoltes, entre autres pour déterminer la composition en eau des champignons, la teneur en matière sèche des oignons ou la composition en solide soluble contenu dans les pommes[3] - [5], la spectroscopie proche infrarouge n’en était qu’à ses débuts. En traitant des échantillons plus gros, par exemple les pommes entières, il ne fallut pas longtemps aux chercheurs pour découvrir que la diffusion des rayons proches infrarouges dans les matériaux dépendait de la microstructure de ceux-ci. Cela voulait donc dire qu’en plus d’être une méthode analytique extrêmement rapide et facile d’utilisation, celle-ci pourrait aussi être utilisée pour déterminer la structure interne des composés. Un tout nouveau monde de possibilités s’ouvrait pour l’expansion de la technique. Déjà répandue dans les domaines de la chimie, de la pharmaceutique, de la pétrochimie et de l’alimentation, on s’en sert maintenant pour l’analyse de la structure des polymères. Le processus étant non destructif, on s’en sert en biologie, on l’utilise en agriculture pour s’assurer que les produits ne contiennent pas de défauts[3] - [6]. À ce jour, il s’agit d’une des techniques les plus répandues dans l’industrie.
Principe de la spectroscopie en proche infrarouge
Principes de bases de la spectroscopie
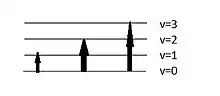
La spectroscopie en proche infrarouge utilise le spectre infrarouge dans ses longueurs les plus proches du visible, soit de 0,78 à 2,5 µm. La technique se base sur la vibration des molécules lors de l’excitation de celles-ci par la source infrarouge. Cette vibration peut être de l’élongation ou lorsque l’on envoie les ondes vers l’échantillon, les électrons excités pourront passer sur les différents niveaux vibrationnels qui sont disponibles sur leur couche de valence. L’absorption par les molécules des ondes infrarouges cause donc le changement des électrons vers des niveaux vibrationnels plus élevés, créant ainsi un signal mesurable.
L’absorption de l’énergie dans les molécules suit une forme linéaire où la concentration est directement proportionnelle à la quantité de lumière, ou plus précisément d’ondes infrarouges absorbées par l’échantillon. Il est alors possible d’utiliser la loi de Beer-Lambert pour la calculer :
où :
- A est l’absorbance (signal) de la molécule,
- ε le coefficient d’absorption de la molécule,
- l la longueur du chemin optique de l’appareil,
- c la concentration de la molécule.
C'est la première technique développée pour la spectroscopie proche infrarouge. C’est encore la technique la plus utilisée dans l'industrie.
Les oscillations harmoniques

Le principal type de vibration qui peut être analysé en SPIR est ce que l’on appelle l’oscillateur d’harmonique. Ce modèle regroupe les interactions d’élongation et de vibration des liens chimiques sous ce modèle physique plus visuel et facile à comprendre. Cette vibration peut être facilement expliquée en se servant d’un modèle très simple, soit celui de deux sphères reliées ensemble par un ressort, comme dans la figure ci-dessous[4] :
Dans ce modèle, la liaison entre deux atomes est représentée par le ressort et les deux masses représentent les atomes. Une fois en mouvement et selon la masse des différents atomes de différentes masses, les masses vibreront dans les deux sens du ressort à une certaine fréquence. Les plus petites masses oscillent à des fréquences élevées et les masses plus élevées à des fréquences plus faibles. Des interactions moléculaires plus fortes, ou ressort <<raide>>, seront difficile à déplacer et reprendront donc leur position initiale très rapidement. À l’inverse, les interactions plus faibles seront facilement déformées par absorption des rayons proche infrarouge et prendront beaucoup plus longtemps avant de reprendre leur forme initiale. La fréquence d’oscillation de cette relation peut être calculée avec la formule suivante :
où :
- ν est la fréquence de vibration,
- k la constante de force de la liaison,
- μ la masse réduite des atomes,
- c la vitesse de la lumière.
Chaque atome et chaque lien ayant leur propre masse et leur propre force respectivement, chaque interaction est unique et peut donc être analysée par spectroscopie proche infrarouge. Comme chaque interaction est unique, cela veut dire que chacune à une fréquence différente et donc une longueur d’onde différente dans le spectre SPIR[5]. Pour expliquer comment déterminer de manière qualitative la formule d’une molécule et déterminer sa structure, on peut utiliser le modèle des oscillateurs harmoniques. Par contre, au lieu d’utiliser le modèle entre deux sphères et un ressort, il est plus facile d’imaginer les ressorts comme étant les cordes d’une guitare, dans le sens où plusieurs harmoniques sont vus au même moment. Dans cette optique, on pourrait donc dire que chacune des interactions de vibrations émettrait une « note » et la résultante, donc la formule de la molécule serait « l’accord » résultant de toutes les notes. Pour résumer, nous obtiendrons alors un spectre comportant toutes les vibrations détectées par l’appareil et il sera possible de déterminer en présence de quelle molécule nous nous trouvons.
Les liaisons analysables en SPIR
Comme dit plus haut, en analyse proche infrarouge, on calcule les fréquences de vibrations en se basant sur le modèle des oscillations harmoniques. Ce modèle peut être vu en particulier pour les liaisons de la forme X-H où X représente les molécules organiques fréquentes, soit le C, le N, le O et le S. Dans cette optique, il y a donc plusieurs types de liaisons et de groupements fonctionnels qui peuvent être vus et interprétés. Les types de vibrations majoritaires sont les suivants : les vibrations d’élongation des C-H dans les méthyles, les vibrations d’élongation dans les C-H des méthylènes, les vibrations d’élongation des C-H aromatique et les vibrations d’élongations des fonctions O-H (alcool, acide carboxylique, etc.). On note aussi certains autres types de vibrations. Bien que minoritaires, celles-ci restent importantes lors de l’analyse d’un spectre infrarouge. Ces modes de vibrations sont les suivantes : Les déformations des C-H des méthoxy, les déformations des C-H dus à l’association des molécules à des carbonyles, les N-H des amides primaires et secondaires (autant dans les fonctions alkyle et aryle), les N-H des amines primaires, secondaires et tertiaires et finalement les N-H formant la structure des sels aminés[3]. Des oscillations harmoniques peuvent aussi être vues dans certains cas, soit celles des C=O, C-C et C-Cl[2]. Ces vibrations sont toutefois très faibles et dans plusieurs cas, elles sont absentes. Il est à noter que la vibration des liens chimiques peut néanmoins être altérée par différents facteurs. La principale <<interférence>> de la vibration peut être associée aux interactions entre les molécules. Par exemple, il peut y avoir des ponts H ou des interactions dipôle-dipôle entre deux molécules, ce qui affecte le mouvement des atomes d’hydrogène[2]. Cela aura donc pour effet de modifier les énergies de vibration ou encore de modifier la longueur d’onde qui sera absorbée par le lien. Si cela survient, on verra donc un changement dans la longueur d’onde d’absorbance de certains liens, ce qui explique l’intervalle de longueur d’onde qui peut être noté pour certaines vibrations, ou peut introduire sur le spectre de toutes nouvelles bandes dû au changement dans la forme cristalline du solide organique. C’est grâce à ces différences dans les spectres que l’on pourra différencier les différentes formes cristallines ainsi que certaines propriétés physico-chimiques. Parmi celles qui pourront être observées dans les solides pulvérisés, on note entre autres la densité, la viscosité ainsi que la grosseur des particules[2]. C’est grâce à cette capacité de déterminer certaines caractéristiques des solides qu’il est possible d'étudier par exemple les fruits et légumes entiers, comme mentionné plus haut.
Montage et instrumentation
L’instrumentation de la spectroscopie proche infrarouge est généralement composée :
- L’échantillon : C’est une petite quantité d’un produit solide, liquide, semi-solide, poudre ou autre à analyser. Celui-ci sera bombardé par les différentes longueurs d’onde utilisées.
- Une source lumineuse : C’est une lumière monochromatique qui émet de l’énergie lumineuse à travers un filtre vers notre échantillon. La diode laser est le plus souvent utilisée.
- Monochromateur : Celui-ci est un dispositif traitant le comportement et les propriétés émises par la source lumineuse permettant ensuite de sélectionner une gamme de longueurs d’onde possible à partir des faisceaux lumineux. Finalement, il produira un rayonnement d’une seule couleur.
- Filtre proche infrarouge : Ce filtre permet de laisser les différentes longueurs d’onde désirées du proche infrarouge émises par la source lumineuse.
- Cuvette : C’est un récipient dans lequel on met notre échantillon à analyser. En général, nous utilisons une cuve en quartz.
- Détecteur : L’énergie lumineuse provenant de l’échantillon en question est analysée par le détecteur. L’énergie lumineuse sera donc convertie en signal électrique.
- Micro-ordinateur : C’est un système informatique qui est relié directement au spectromètre. Il permet de contrôler l’instrument à partir de nombreux paramètres différents pour l’analyse désiré de l’échantillon et bien sûr afficher les résultats obtenus à la suite du traitement du signal provenant du détecteur.
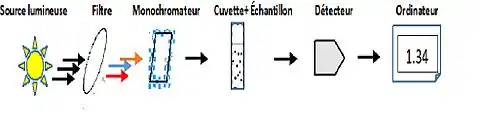 Figure 3: Schéma d'un spectromètre en proche infrarouge
Figure 3: Schéma d'un spectromètre en proche infrarouge
Applications
La spectrométrie proche infrarouge est une technique analytique appliquée dans divers domaines. Par exemple :
- industrie pharmaceutique. L’utilisation du NIR dans le domaine pharmaceutique vers la fin des années 60 était principalement pour l’étude des interactions pont hydrogène des amides et amines5 ainsi que l’analyse quantitative de ceux-ci en solution. Quelques années plus tard, les analyses telles que l’humidité, la détermination de la composition des médicaments, dosage des produits pharmaceutiques (ex : tablettes, capsules, etc.) étaient possibles grâce à NIR[4] ;
- industrie agroalimentaire. L’application du NIR dans ce domaine permet d’effectuer des analyses importantes telles que l’humidité dans les aliments, la quantification de protéine, gras, sucres et hydrate de carbone[4] ;
- industrie chimique. Tout ce qui a trait à la caractérisation des polymères, l’analyse des hydrocarbures présente par exemple dans l’huile ou le pétrole est possible grâce au NIR. De la même manière qu’il est possible d’effectuer l’analyse des composés organiques et inorganiques, des hydrocarbures présentent dans les eaux usées par exemple[4].
On retrouve cette technique dans les domaines du pétrole, des matériaux, du textile et dans d'autres industries.
Avantages et inconvénients
Avantages :
- haute résolution spectrale ;
- temps d’analyse très court ;
- reproductibilité et fiabilité ;
- instrument facile à manipuler ;
- haute sensibilité (plusieurs acquisitions en même temps) ;
- possibilité d’analyser des produits solides et liquides à l’état pur (l’échantillon n’a pas besoin d’être préparé).
Inconvénients :
- gamme spectrale restreinte ;
- la taille des particules et l’orientation peuvent changer les spectres.
Notes et références
Notes
- On qualifie cette gamme de longueurs d'onde de proche parce qu'elle suit immédiatement le domaine visible (0,38 à 0,78 µm).
Références
- Donald A. Burns, Emil W. Ciurczak (2008), Handbook of Near-Infrared Analysis, Third Edition, Boca Raton (États-Unis) : CRC Press, 816 pages.
- M. Blanco, I. Villarroya (2002), NIR spectrosopy : a rapid-response analytical tool. TrAC Trends in Analytical chemistry 21(4) : 240-250.
- Bart M. Nicolaï, Katrien Beullens, Els Bobelyn, Ann Peirs, Wouter Saeys, Karen I. Theron, Jeroen Lammertyn(2007), Nondestructive measurement of fruit and vegetable quality by means of NIR spectroscopy : A review. Postharvest Biology and technology 46(2) : 99-118.
- H. W. Siesler, Y. Ozaki, S. Kawata, H.M. Heise (2002), Near-Infrared Spectroscopy : Principles, Instruments, Applications, Weinheim (Allemagne) : Wiley-VCH, 347 pages.
- J. Workman, L. Weyer (2012), Practical guide and spectral Atlas for interpretive near-infrared spectroscopy, second edition, Boca Raton (États-Unis) : CRC Press, 323 pages.
- V. Pansare, S. Hejazi, W. Faenza, R.K. Prud’homme (2012), Review of long-wavelength optical and NIR imaging materials : Contrast agents, fluorophores and multifunctional nano carriers. PMC Chem Mater 24(5) : 812-827.
Voir aussi
Articles connexes
Liens externes
- HélioSPIR, SIte de l'association francophone de spectrométrie dans le proche infrarouge

