Récepteur GABAB
Les récepteurs GABAB sont des protéines membranaires (Récepteur métabotrope) intervenant dans la transmission de l’acide gamma-aminobutyrique (GABA), neurotransmetteur inhibiteur du système nerveux central (cerveau et moelle épinière).
Ce dernier a pour fonction de diminuer l’activité nerveuse des neurones sur lesquels il se fixe. Il interviendrait dans de nombreux processus physiologiques comme la mémorisation, le sommeil ou la dépendance aux drogues. Véritable frein pour la transmission de l’influx nerveux, le GABA servirait entre autres à contrôler la peur ou l’anxiété qui se manifeste par une surexcitation neuronale. Ainsi, il apparaît qu’un dysfonctionnement du système GABAergique est à l’origine de nombreux troubles du système nerveux (Bettler et al., 2004). Alors qu'une hyperactivité de ce système est associée à la schizophrénie, une hypoactivité peut provoquer des crises d’épilepsie, d’anxiété, des états dépressifs ainsi que des troubles du sommeil. Sur la base de ce simple constat, il semble évident que la mise au point de molécules capables de réguler le fonctionnement du système GABAergique représente un enjeu majeur pour l’industrie pharmaceutique (Martin et Dunn, 2002) (Figure 1). Ceci implique une meilleure compréhension des mécanismes moléculaires régissant le fonctionnement de ce système. Sur le plan physiologique, les effets du GABA sont médiés via l’activation de récepteurs ionotropiques, GABAA et métabotropiques, GABAB. Ces deux types de récepteurs sont des cibles potentielles pour le développement de nouveaux médicaments.
Isoformes du récepteur GABAB
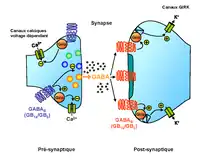
Le récepteur GABAB existe sous deux populations se différenciant par leur fonction et leur localisation pré- ou postsynaptiques. En effet, ce récepteur hétérodimérique constitué de deux sous-unités GABAB1 (GB1) et GABAB2 (GB2), présente deux isoformes de GB1, GB1a et GB1b. Ces deux variants se distinguent respectivement par la présence ou non de deux domaines sushi dans leur région extracellulaire. L'isoforme GB1a est exprimée très tôt à l’issue de la naissance et se localise au niveau pré-synaptique alors que GB1b est exprimée plus tardivement au niveau post-synaptique (Kaupmann et al., 1998 ; Fritschy et al., 1999 ; Vigot et al., 2006). Globalement, ces deux populations de récepteurs sont largement distribuées dans le système nerveux central et dans les terminaisons périphériques autonomes. La population pré-synaptique semble essentiellement couplée aux canaux calciques (blocage de l’entrée de calcium) et régule l’exocytose des neurotransmetteurs présents dans les terminaisons nerveuses. L’inhibition des canaux calciques passe par des protéines Gi/o couplées au récepteur (Strock et Diverse-Pierluissi, 2004) alors que l’inhibition de l’exocytose passe par un blocage de la machinerie de fusion membranaire dont le mécanisme reste encore méconnu à ce jour (Capogna et al., 1996 ; Wu et Saggau, 1997 ; Spafford et Zamponi, 2003) (Figure 2). La population post-synaptique semble quant à elle préférentiellement couplée aux canaux GIRK (Courant potassique rectifiant activé par les protéines G)(Luscher et al., 1997). Cet effet passe par le complexe béta/gamma associé aux protéines Gi/o, qui favorise la sortie d’ions potassium via l’ouverture de canaux potassiques. Cette sortie d’ions positifs entraîne une hyperpolarisation des neurones post-synaptiques qui contribue à augmenter le seuil d’excitabilité du neurone (McCormick, 1989).
Le récepteur GABAB : un hétérodimère obligatoire...
En 1997, le premier ADNc du récepteur GABAB fut cloné (Kaupmann et al., 1997). Ce récepteur nommé GB1, bien qu’étant capable de lier différents ligands dont le GABA, n’est pas fonctionnel car non adressé à la surface cellulaire (Couve et al., 1999). En effet, la présence d’une séquence minimale de type RSR (Arginine-Serine-Arginine) au niveau de son domaine carboxy-terminal est responsable de sa rétention au niveau du réticulum endoplasmique (RE). Récemment, des travaux ont permis d’identifier la liaison de protéines COPI au niveau de ce motif (Brock et al., 2005). Cette interaction avec COPI est responsable du transport rétrograde de GB1, exprimé seul, du cis-Golgi vers le RE. Cependant, même lorsque ce système de rétention est rendu inopérant par mutation, la sous-unité GB1 atteint la surface cellulaire seule mais ne peut activer les protéines G. Ceci suggérait qu’une autre protéine associée à GB1 était nécessaire à sa fonction.
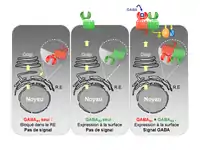
Un an après la découverte de GB1, un récepteur homologue nommé GB2 fut cloné (Jones et al., 1998 ; Kaupmann et al., 1998 ; White et al., 1998 ; Kuner et al., 1999 ; Ng et al., 1999). Ce récepteur exprimé seul, est bien adressé à la surface cellulaire mais est incapable de lier le GABA. Lorsqu’il est co-exprimé avec GB1, il permet alors la formation d’un récepteur fonctionnel possédant toutes les propriétés décrites pour le récepteur GABAB neuronal (Marshall et al., 1999). L’identification d’un motif d’interaction de type superhélicoïdal entre les domaines C-terminaux de GB1 et GB2 a permis de mieux comprendre le mécanisme d’adressage de l’hétérodimère à la surface cellulaire (Kammerer et al., 1999). En effet, l’interaction des domaines C-terminaux de GB1 et GB2, à l’issue de leur synthèse dans le RE, conduirait à la formation de la structure superhélicoïdale essentielle au masquage du motif RSR présent chez GB1. Cette interaction ne permettrait pas aux protéines COPI d’accéder à ce motif, favorisant ainsi l’envoi en surface de l’hétérodimère (Bouvier, 2001 ; Pin et al., 2004) (Figure 3). Toutefois, GB2 n’a pas qu’un rôle de protéine d’adressage. En effet, GB1 muté en son site de rétention, nommé GABAB1asa, atteint seul la surface cellulaire (Pagano et al., 2001). Cette sous-unité reconnaît les ligands (Galvez et al., 1999, 2000) mais n’active pas les protéines G. La sous-unité GB2 est donc indispensable à la fonctionnalité du récepteur. En fait, il semble que ce soit GB2 qui se couple aux protéines G (Duthey et al., 2002 ; Galvez et al., 2002). Ces données supportent donc l’hypothèse d’une trans-activation allostérique du récepteur GABAB. Ainsi, ce serait la liaison du GABA sur GB1 qui conduirait à l’adoption par GB2 d’une conformation favorable à un couplage aux protéines G (Galvez et al., 2001). Cette interaction GB1/GB2 semble très spécifique. Cependant, les deux sous-unités généralement colocalisées dans la plupart des régions du cerveau (Bischoff et al., 1999) se retrouvent parfois exprimées dans des régions distinctes (Jones et al., 1998 ; Kaupmann et al., 1998 ; Kuner et al., 1999). ). La sous-unité GB1 a été ainsi retrouvée dans certaines régions du cerveau n’exprimant pas la sous-unité GB2. Ce dernier point ne permet donc pas d’exclure que GB1 puisse présenter des rôles indépendants de GB2 qui sont encore indéterminés à ce jour.
Les récepteurs de classe C
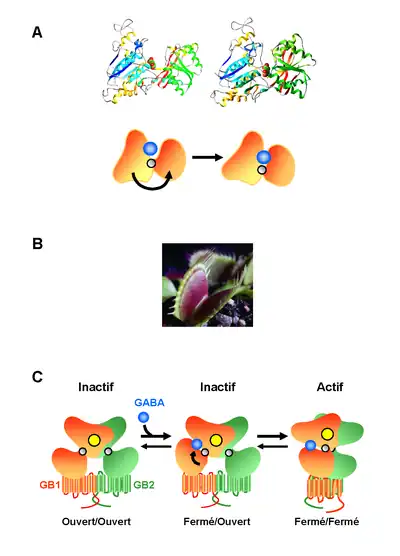
La particularité des récepteurs de classe C vient de la structure de leur domaine N-terminal extracellulaire où se fixe le ligand. En effet, la résolution de la structure de ce domaine pour le récepteur du glutamate de type 1 (mGlu1) (Kunishima et al., 2000) de la même famille que le récepteur GABAB montre qu’il s’agit de deux lobes se faisant face (Kaupmann et al., 1997 ; Galvez et al., 1999) (Figure 4). Ces lobes sont capables de se refermer sur le ligand agoniste à l’image de la fermeture des deux lobes de la dionée (plante carnivore appelée aussi « gobe mouche ») au contact d’un insecte. Ainsi, alors que la forme ouverte semble prépondérante en l’absence de ligand, la fixation d’une molécule agoniste au niveau de ces domaines stabiliserait la forme fermée. La résolution des structures cristallographiques des domaines externes de mGlu1, en présence ou absence d’agoniste, a permis de montrer que cette fermeture s’accompagne d’un changement conformationnel aboutissant à une modification de l’orientation relative des deux protomères. Ce mouvement de grande amplitude entre sous-unités permettrait le passage à l’état actif du domaine heptahélice conduisant à l’activation des protéines G.